Documento
Observatorio del Medicamento - Federación Médica Colombiana
Informe preliminar sobre borrador de Circular 04 de 2013 de la CNPMyDM
Contextualizar nuevo sistema de regulación de precios de medicamentos y concentrar esfuerzos en su profundización
Boletín Informática y Salud Boletín del Consumidor de Medicamentos ISSN-0121-4675 Res.Min.Gob.036/1991
Año 23 (1991-2013) Boletín N°30 22 a 28/julio/2013 Bogotá – Colombia
Observatorio del Medicamento – OBSERVAMED
de la Federación Médica Colombiana – FMC
Junta Directiva Federación Médica Colombiana - FMC
Dr. Sergio Isaza Villa, Presidente Federación Médica Colombiana – FMC
Dr. César Prieto Avila, Vicepresidente FMC y Presidente Colegio Médico del Valle
Dr. Sergio Robledo Riaga, Vicepresidente Financiero FMC y Presidente Colegio Médico Cundinamarca
Dr. Gentil Gómez Mejía, Secretario General FMC y Presidente Colegio Médico del Tolima
Dr. Adán Muñoz Vera, Fiscal Médico FMC y Presidente Colegio Médico de Santander
Dra. Luisa de la C. Salamanca, Fiscal Suplente FMC y Presidente Colegio Médico de Santander
Dr. Jorge E. Maldonado Avendaño, Vicepresidente Educación Médica Continua - FMC
Dr. Germán Fernández Cabrera, Vicepresidente de Asuntos Gubernamentales - FMC
Dr. Oscar Andia Salazar, Vicepresidente Política Farmacéutica Nacional – FMC
Dirección Ejecutiva OBSERVAMED
Boletín Informática y Salud y Boletín del Consumidor de Medicamentos
Tatiana Andia Rey, Investigadora Asociada
OBSERVAMED – Federación Médica Colombiana
Leonardo Ferreira Rey, Investigador Asociado
OBSERVAMED – Federación Médica Colombiana
Marina Rey de Andia, Gerente Administrativa y Financiera de OBSERVAMED
Alberto Melo Salazar, Investigador Asuntos Legales y Aseguramiento en Salud OBSERVAMED
Humberto Figueroa Gómez, Ingeniero Jefe de Sistemas de OBSERVAMED
Oscar Andia Salazar, Director de OBSERVAMED
Vicepresidente de Política Farmacéutica Nacional – Federación Médica Colombiana
Miembro de la Junta Directiva del Colegio Médico de Cundinamarca y Bogotá
Director Emérito: Dr. Enrique Núñez Olarte MD, QF, FBQ
Oficinas OBSERVAMED
Carrera 47 A N° 114 A – 39 Bogotá Colombia Tel 2132421 Fax 2132260
Correo oficial del Observatorio del Medicamento
Informe preliminar sobre borrador de Circular 04 de 2013 de la CNPMyDM
Contextualizar nuevo sistema de regulación de precios de medicamentos y concentrar esfuerzos en su profundización
Oscar Andia Salazar, Director de OBSERVAMED
Vicepresidente de Política Farmacéutica Nacional – Federación Médica Colombiana
Tatiana Samay Andia Rey, Investigadora Asociada
OBSERVAMED – Federación Médica Colombiana
Boletín Informática y Salud Boletín del Consumidor de Medicamentos ISSN-0121-4675 Res.Min.Gob.036/1991
Año 23 (1991-2013) Boletín N°30 22 a 28/julio/2013 Bogotá – Colombia
TABLA DE CONTENIDO
2. De la desregulación, a una regulación parcial e insuficiente………………………………………………pág.6
3. De la regulación parcial e insuficiente, a la Circular 04/2013: Un paso en la dirección correcta……pág.6
4. El reto de perfeccionar más PMV y llevar la regulación a las farmacias…………………………………pág.8
5. Otros mecanismos de regulación indirecta……………………………….………………………………….pág.11
6. Desafíos de la nueva regulación…………………………………………………………………………….…pág.14
6.1. David versus Goliat………………………………………………………………………………….……….pág.14
6.2. Necesidad de un sistema de información más robusto ……………………………………. ……….pág.14
6.3. Ajustes a la base de datos y las funciones del INVIMA………………………………….…………….pág.14
6.4. Que la Superintendencia de Industria y Comercio y la Supersalud cumplan su labor.……….pág.15
6.5. Necesidad de una visión macroeconómica…………………………………………………….……….pág.15
Autorización Para Reproducciones No Comerciales
Este informe puede ser impreso o reproducido por cualquier medio
para su utilización con fines de defensa de la salud pública
Federación Médica Colombiana
75 Años Defendiendo la Salud Pública y
el Ejercicio Etico de la Profesión Médica
1. PRESENTACIÓN
En la reunión de presentación del borrador de Circular 04 de 2013, Observamed preguntó "si había
borrón y cuenta nueva". La respuesta del Ministro Alejandro Gaviria y su equipo técnico fue
enfática y unánime: NO. Las Circulares 03 y 04 de 2013 (borrador), no derogan los Precios
Máximos de Venta (PMV) definidos por la Circular 04 de 2012. Por lo tanto, los esfuerzos
regulatorios de casi 3 años de la administración Santos -con sus virtudes y defectos- quedan
vigentes, hasta tanto sean modificados por nuevas Circulares. Un análisis preliminar de los nuevos
PMV muestra que efectivamente mejoran los anteriores y -desde luego- se trata de un paso
en la dirección correcta.
Click aquí para v Ver V V
Declaración de ausencia de conflicto de interés: Este informe no contó con el financiamiento de ninguna
entidad pública o privada -nacional o internacional- que obtenga algún beneficio para su interés particular con
la publicación de los hechos observados. No entra en conflicto con los valores y la misión de la Federación
Médica Colombiana, de defender el ejercicio ético de la profesión médica y los intereses de la salud pública. Esperamos sus observaciones, críticas y sugerencias en el c
Dr. Oscar Andia Salazar
Director General
Observatorio del Medicamento OBSERVAMED
Federación Médica Colombiana
Colegio Médico de Cundinamarca y Bogotá
2. De la desregulación, a una regulación parcial e insuficiente
Para contextualizar adecuadamente las Circulares 03 y 04 (borrador) de 2013, de la Comisión Nacional de Precios de Medicamentos y Dispositivos Médicos (CNPMyDM) es necesario mencionar los siguientes hechos:
a) En las postrimerías del anterior gobierno, cuando el crecimiento exponencial de recobros
era un hecho innegable, el ministro saliente, reconoció lo erróneo de la política de desregulación total de precios de medicamentos y su impacto negativo en la crisis financiera del sector salud. A última hora, se intentaron algunas medidas correctivas que resultaron ser más mediáticas que efectivas y el año 2010 los recobros llegaron a Col$ 2,4 billones. V
b) Al comenzar la administración Santos, se fijó el objetivo de controlar ese fenómeno y
adoptó un sistema de regulación basado en "Valores Máximos de Recobro (VMR). Expidió elque facultaba a MinSalud para fijar dichos VMR y con las Resolucionesde 201de 2011, además de lade 2012, dijeron haber logrado controlar los sobreprecios de 163 principios activos, equivalentes al 98% de medicamentos de mayor impacto en los recobros al FOSYGA. El año 2011 los recobros bajaron de Col$ 2 billones. Ver la mism
c) El Decreto 4474 fue demandado ante el Consejo de Estado, que aceptó la demanda y dejó
en el limbo los VMR. Para evitar un vacío regulatorio, la CNPMyDM expidió la Circular 04 de 2012 que sumó a los VMR, el 12% de margen de servicio farmacéutico y los convirtió en nuevos Precios Máximos de Venta (PMV).
d) Ese sistema de regulación, basado en VMR y su discutible conversión en PMV, fue
criticado, por ser parcial e insuficiente. Parcial, porque afectaba básicamente a los precios
institucionales (y no a los precios exorbitantes en farmacias). Insuficiente, porque varios
de los precios institucionales, seguían siendo exageradamente más elevados que -por
ejemplo- los precios de referencia en España. V
e) Las diferencias de percepción eran evidentes. Por ejemplo, lue
presentada por los ministerios deom (enfatizando un supuesto efecto masivo que estaba en línea con
los objetivos del Documento CONPES de PFN-2012 y las promesas del Presidente
Santos) mientras, organizaciones de la sociedad civil criticaban lo parcial e insuficiente
de la medida y advertían que la eliminación del margen de 12% de los prestadores
(hospitales y clínicas que deben cubrir gastos del servicio farmacéutico) permitiría que
algunas farmacéuticas, abusen de su posición dominante y conviertan una parte variable
de ese 12%, en un aumento de precios, en ocasiones superior al IPC, o la inflación.
3. De la regulación parcial e insuficiente, a la Circular 04/2013: Un
paso en la dirección correcta
En el contexto descrito, la revisión de los PMV fijados por el borrador de la Circular 04 de 2013 para 66 productos que reportaron ventas a SISMED 2012, sugiere un impacto de aproximadamente $Cols 370.000 millones en disminución de sobrecostos (suponiendo un año futuro con el mismo número de unidades vendidas el 2012 y los nuevos PMV, si son ratificados). Sin duda, se trata de un paso en la dirección correcta, con las primeras 37 moléculas que tenían PMV "insuficiente" o superior al precio internacional. V
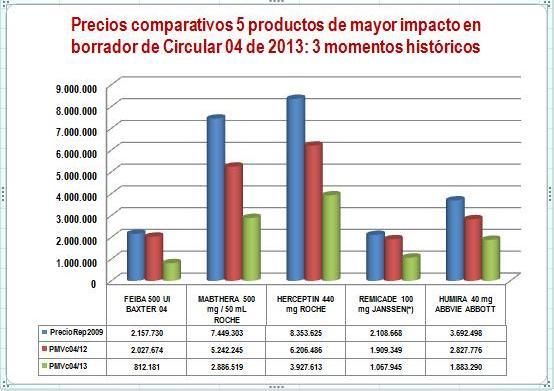
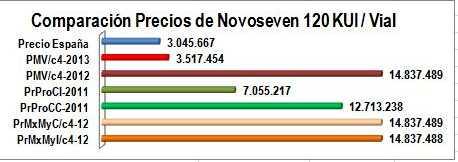
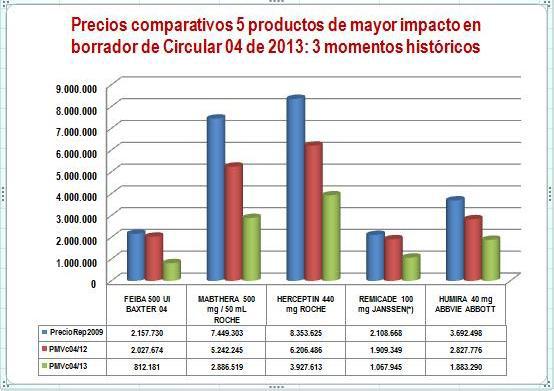
Para mostrar gráficamente este hecho, tomamos los 5 productos de mayor impacto del informe anterior y comparamos el precio promedio reportado por el laboratorio a Sismed 2009 (precios reales durante el anterior gobierno) con el PMV de la Circular 04 de 2012 (equivalente a VMR+12% de servicio farmacéutico) y los PMV del borrador de la Circular 04 de 2013. Ver Figura N°1.
Figura N°1: Evolución precios 2009-2013 de 5 productos de alto impacto
(*) Precio reportado de Remicade corresponde a 2010 por inconsistencias en reportes de Janssen del año 2009.
Otro ejemplo que permite ver la rectificación que implica el borrador de la Circular 04 de 2013, puede verse en la Figura N°2:
Figura N°2: Comparación precios de NOVOSEVEN 120 KUI/Vial
Precio de Referencia AEMPS 2012
Precio Máximo de Venta Circular 04 de 2013 Precio Máximo de Venta Circular 04 de 2012
Precio Promedio Canal Institucional Sismed 2011*
Precio Promedio Canal Comercial Sismed 2011*
Precio Mayorista Canal Comercial Sismed 2012
Precio Mayorista Canal Institucional Sismed 2012
a) Nótese que el nuevo PMV del borrador de Circular 04 de 2013 (columna roja), se aproxima
al precio de referencia español (columna azul) que es similar al de más de 20 países de la Federación Mundial de Hemofilia,
b) El antiguo VMR de Factor VIIa Recombinante + 12% de servicio farmacéutico, convertido
en PMV de la Circular 04 de 2012 era claramente "insuficiente" o erróneo (ver Inciso c del punto 1),
c) Los precios reportados a Sismed 2011 por Amarey NovaMedical la comercializadora que
representaba a Novo Nordisk con este producto, corresponde a más del doble y triple de los valores de referencia, en los canales institucional y comercial (columnas verdes). Nota: Tomamos reportes del año 2011 porque sus ventas del año 2012 no fueron reportadas a SISMED,
d) Los precios reportados por los mayoristas a Sismed 2012, por canal comercial e
institucional, son equivalentes al PMV de 2012 (columnas color naranja). Nótese que la regulación con PMV "insuficientes" o errados, induce prácticas perversas.
e) La rectificación en la metodología de fijación de nuevos PMV, no es suficiente. Debe
acompañarse de ajustes al sistema de seguimiento de la información reportada y desestímulo de prácticas perversas.
Estos ejemplos muestran que el borrador de la Circular 04 de 2013 constituye un avance regulatorio que debe valorarse con objetividad. El anuncio ministerial de un ahorro de Col$ 400.000 millones anuales parece realista, si no se producen cambios importantes en la semana de revisión y el consumo se incrementa un 10% en unidades. Pero, es claramente insuficiente, porque los recobros siguen rondando los Col$ 2 billones y el objetivo fijado en el Documento CONPES de Política Farmacéutica, de reducir esa suma a Col$ 500.000 millones (0,5 billones) anuales a partir del año 2014, está muy lejos de cumplirse.
Además, el problema de los sobreprecios exorbitantes en las farmacias persiste sin mayor modificación, tal como lo demuestran los múltiples testimonios que se difunden por las redes sociales y todos lo medios de comunicación. Queda pendiente una colosal tarea de perfeccionar más PMV de la Circular 04 de 2012 y ampliar la regulación a los precios abusivos en los puntos de venta, que son los que más afectan el gasto de bolsillo de los pacientes.
4. El reto de perfeccionar los PMV y llevar la regulación a farmacias
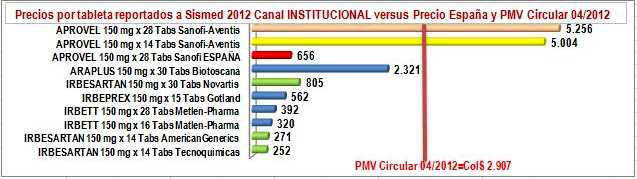
Asumiendo que la regulación e los medicamentos cuyo mayor consumidor es el propio sistema comienza a marchar por buen camino y asumiendo que la fórmula será mejorada y aplicada a los demás productos de ese grupo, el siguiente paso es llevar la regulación, a los precios exorbitantes en las farmacias. Sin duda, esto implica una mayor complejidad regulatoria, que va más allá de la simple fijación de Precios Máximos de Venta y obliga la adopción de otros mecanismos de regulación directa e indirecta. Para ver esta complejidad y la necesidad de otros mecanismos regulatorios, tomamos el ejemplo de APROVEL (IRBESARTAN de Sanofi-Aventis) que mencionó Juan Gossaín en su último artícul junto con sus marcas y genéricos. Ver Tabla N°1.
Tabla N°1: Precios Reportados, Encuestados y Regulados de IRBESARTAN 150 mg
Nombre del Producto
Laboratorio
PMV12 Cant PpCIu
IRBESARTAN 150 mg
IRBESARTAN 150 mg
AMERICAN_GENERICS
IRBESARTAN 150 mg
Precio APROVEL 150 mg x 28 tabs España = 7,79 Euros x 2.311,15 (TPA2012)=>
Precio AEMPS por tableta en Col$=>
PpCI = Precio Promedio Canal Institucional PpCIu = Precio Promedio Canal Institucional Unitario PpCC = Precio Promedio Canal Comercial
PpCCu = Precio Promedio Canal Comercial Unitario PPE = Precio Público Encuestado OBSERVAMED en Farmacias PPEu = Precio Público
Encuestado OBSERVAMED en Farmacias Unitario PMV12 = Precio Máximo de Venta fijado por Circular 04 de 2012 PMVu = Precio Máximo de
Venta fijado por Circular 04 de 2012 Unitario
Para comenzar el análisis debemos darle la razón a Juan: El precio de la Agencia Española de
Medicamentos y Dispositivos Médicos (AEMPS) para APROVEL 150 mg por 28 tabletas, es de
7,79 Euros, que a la tasa de cambio promedio anual de 2012 (Col$ 2.311,15) equivale a Col$
18.374, mientras "en Colombia, con el mismo nombre, hecho por el mismo laboratorio, metido en el
mismo empaque, con las mismas 28 pastillas de los mismos 150 miligramos" se vende a Col$
184.505 (Precio Público Encuestado OBSERVAMED, ligeramente inferior al precio del artículo Col$
189.200), un precio diez veces mayor, que nadie puede justificar desde una perspectiva ética,
científica o económica razonable.
Recordemos luego que, esta situación es resultado de una política pública de desregulación de
precios o liberalización a ultranza que se implementó en Colombia desde 2003 y culminó con la
Circular 04 de 2006 (vy lo dicho en el punto 1 de este informe). Los intentos de
regulación de la administración Santos llegaron hasta un Valor Máximo de Recobro (VMR) de
IRBESARTAN de Col$ 17,30 el mg, que por 150 mg y 28 tabletas, daba un sub total de Col$
72.660 que más el 12 % de servicio farmacéutico daba el total de Col$ 81.379 (Resolución 2569 de
30ago12). La Circular 04 de 2012 fijó el Precio Máximo de Venta (PMV) de IRBESARTAN Cápsula,
Tableta y/o Comprimido en Col$ 19,38/mg, que por 150 mg y por 28 tabletas equivale a Col$
81.396 (y Col$ 2.907 por tableta que aparece en la tabla en letras color marrón).
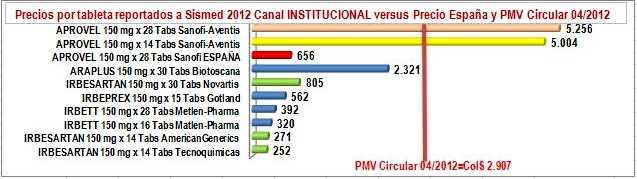
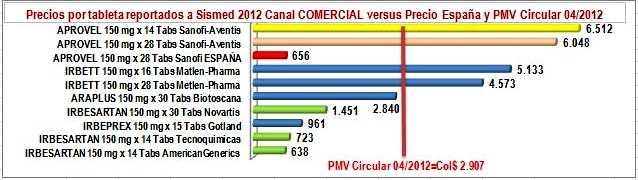
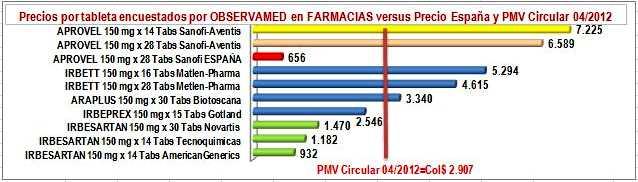
Ya en la tabla, diferenciemos la parte izquierda donde en líneas amarillas están 2 presentaciones de la "marca original o pionera", en líneas azules tres "marcas secundarias o genéricos de marca" y en líneas verdes tres genéricos de Irbesartan. En la parte derecha diferenciemos los precios por tableta, en la columna verde el precio unitario reportado por los laboratorios en canal institucional, en azul lo reportado por los laboratorios en canal comercial, en amarillo suave el unitario del precio encuestado por OBSERVAMED en farmacias y amarillo intenso del PMV unitario de la Circular 04 de 2012. Luego, veamos los siguientes hechos:
a) No es verdad que esta administración no haya hecho nada para controlar este caos de
precios. Fijó un PMV "insuficiente" que es 4 veces superior al precio en España, pero contribuyó a detener el crecimiento de los recobros (v
b) En este caso específico, la marca pionera APROVEL -según sus propios reportes al
SISMED- NO respetó los VMR o PMV fijados por el gobierno y sin embargo no se hizo pública ninguna sanción. Ver Figura N°3.
c) Entre los precios reportados por los laboratorios en el canal institucional, las marcas
secundarias y los genéricos respetan los PMV. Los genéricos de Tecnoquímicas y Lafrancol son razonablemente más bajos que el precio público del pionero en España y el genérico de Novartis es ligeramente superior. Las marcas secundarias de Gotland y Metlen Pharma tienen un comportamiento similar, pero Biotoscana se "pega" al precio de referencia y más que quintuplica el precio de las otras marcas secundarias y genéricos. Ver Figura N°3.
d) Entre los precios reportados por los laboratorios en el canal comercial -el que afecta las
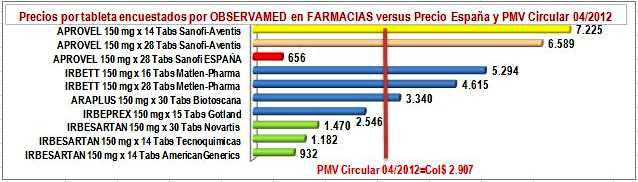
farmacias- solo American Generics (Lafrancol) reportó un precio inferior al precio público del pionero en España. El genérico de Tecnoquímicas y la marca secundaria de Gotland son ligeramente superiores y el genérico de Novartis más que duplica ese precio. La marca secundaria de Biotoscana cuadruplica el precio del pionero en España y la de Metlen Pharma es 7 veces superior. Ver Figura N°4.
e) El precio público encuestado por OBSERVAMED en farmacias, tiene un comportamiento
paralelo al de los precios reportados por canal comercial, con márgenes razonables, excepto el genérico de Tecnoquímicas que bordea el margen de 50% y la marca de Gotland que supera el 100%. Nótese que, es el laboratorio el que empuja al alza los
precios al público, lo cual contradice a los opinadores que culpan de los precios perversos a la intermediación. Ver Figura N°5.
FigN°3: Precios unitarios reportados IRBESARTAN 150 mg. Sismed 2012 Canal Institucional
FigN°4: Precios unitarios reportados IRBESARTAN 150 mg. Sismed 2012 Canal Comercial
FigN°5: Precios unitarios encuestados IRBESARTAN 150 mg. OBSERVAMED en Farmacias
Los mercados correspondientes a los demás principios activos mencionados en los artículos de Juan Gossaín, tienen un comportamiento similar. Tienen una "marca original o pionera" que es la dominante, varias "marcas secundarias o genéricos de marca" que pueden tener precios razonables o imitar las prácticas mercadotécnicas de las marcas pioneras y varios genéricos que por lo general tienen precios razonables. A los principios activos que más afectaron los recobros -insistimos- ya se les fijaron VMR y PMV ( los Precios Máximos de Venta PMV de la Circular 04 de 2012 equivalen a los antiguos VMR sumados al 12% de servicio farmacéutico) que en varios casos resultaron insuficientes (ver. En esos casos, de acuerdo con lo visto en las Circulares 03 y 04 de 2013, se les fijarán nuevos PMV o Precios de Referencia Internacional (PRI) que seguramente estarán más cerca del precio público en España.
Revisando el ejemplo de la Tabla N°1 y los gráficos 3 a 5 podemos ver que, cuanto más bajos sean los "Precios de referencia por comparación internacional (PRI)" a fijarse en próximas Circulares, menor será la tendencia a las prácticas perversas de las marcas pioneras y secundarias. Sin duda, será mayor el ahorro del sistema y -si se cumplen las predicciones de MinSalud- se regularán también los precios perversos al público en las farmacias. Pero esta parte de la regulación es más compleja y debe estar acompañada de otras medidas indirectas, que complementen su efecto benéfico para el sistema y los pacientes.
5. Otros mecanismos de regulación indirecta
Está claro que los nuevos Precios Máximos de Venta (PMV), por mejorados que sean, no pueden constituirse en el único mecanismo de regulación. Es necesario recurrir a otros mecanismos, como -por ejemplo- la inclusión de nuevas opciones en el plan de beneficios del sistema y grandes campañas informativas sobre el uso correcto de nuevas alternativas.
Estos mecanismos de regulación indirecta de precios ya fueron empleados por la administración Santos. No se trató de un cumplimiento pleno de las órdenes de la Sentencia T-760 de 2008 de la Corte Constitucional, pero sí de avances como la inclusión de Rituximab y Trastuzumab en el actual plan de beneficios o Plan Obligatorio de Salud (POS). Algunos medicamentos de alto consumo en farmacias, varios de ellos incluidos en los artículos de Juan Gossain, también fueron incluidos en el POS: Veamos 4 casos que ilustran las ventajas y limitaciones de estos mecanismos de regulación indirecta.
El caso de Plavix 75 mg (Clopidogrel de Sanofi-Aventis) caja x 28 tabs, muestra 4 hechos: (Ver
Figura N°6)
a) Los precios en farmacias de Colombia resultan casi 5 veces superiores al de España b) El Valor Máximo de Recobro (VMR) antes de su inclusión en el POS y Precio Máximo de
Venta (PMV) de la Circular 04 de 2012 (para indicaciones, terapias y concentraciones no incluidas en el POS) es "insuficiente". Resulta más de 3 veces superior al precio del mismo Plavix 75 mg caja x 28 tabs en España.
c) El Laboratorio respetó el VMR (luego el PMV) en sus reportes a Sismed 2012, por Canal
d) El precio en farmacias está definido por el precio reportado por el Laboratorio en el canal
comercial. El margen de las farmacias es razonable y el agente que define el precio exorbitante -casi 5 veces superior al precio en España- es el laboratorio.
El caso de Risperdal 2 mg (Risperidona de Janssen) Quicklet x 20 tabletas, muestra los mismos
hechos que el anterior (ver Figura N°6), con la diferencia de un VMR (luego PMV para
concentraciones no incluidas en el POS) que resulta realmente "insuficiente" por ser más de 11
veces superior al precio público del mismo producto en España. El Laboratorio respetó el VMR
(luego el PMV) en sus reportes a Sismed 2012, por Canal Institucional. Y también el precio en
farmacias está definido por el precio reportado por el Laboratorio en el canal comercial y el agente
que define el precio exorbitante -casi 21 veces superior al precio en España- es el laboratorio.
El caso de Nexium 20 mg (Esomeprazol de AstraZeneca) por 28 tabletas muestra 4 hechos: (Ver
Figura N°7)
a) El Valor Máximo de Recobro (VMR) antes de su inclusión en el POS y Precio Máximo de
Venta (PMV) de las Circulares 01 y 03 de 2012 que fijan PMV de NEXIUM 20 mg CUM 19915411-05 en Col$ 26.135.- fue "suficiente". ¡Buen trabajo! pero, por alguna razón este producto fue excluido de regulación y no aparece en la Circular 04 de 2012.
b) El Laboratorio NO respetó el PMV en sus reportes a Sismed 2012, por Canal Institucional.
El precio reportado por canal comercial resulta casi 6 veces superior al PMV y no existe ninguna noticia pública de alguna sanción.
c) El precio en farmacias está definido por el precio reportado por el Laboratorio en el canal
comercial. El margen de las farmacias es razonable y el agente que define el precio exorbitante -6 veces superior al precio en España- es el laboratorio.
FigN°6: Precios Reportados, Encuestados y Regulados PLAVIX 75 mg y RISPERDAL 20 mg
Finalmente, el caso de Lipitor 20 mg (Atorvastatina de Pfizer) por 30 tabletas, muestra hechos
similares (ver Figura N°7): El VMR (luego PMV para concentraciones no incluidas en el POS)
resulta "insuficiente" por ser 4 veces superior al precio público del mismo producto en España. El
Laboratorio respetó el VMR (luego el PMV) en sus reportes a Sismed 2012, por canal Institucional.
Y -nuevamente- el precio en farmacias está definido por el precio reportado por el Laboratorio en el
canal comercial y el agente que define el precio exorbitante -10 veces superior al precio en
España- vuelve a ser el laboratorio.
Calcularemos el impacto del nuevo sistema de regulación en estos 4 productos, cuando aparezcan
sus nuevos PMV "para indicaciones y concentraciones no incluidas en la plan de beneficios". Por el
momento, solo destacamos los siguiente hechos:
a) Las ventas reportadas de Plavix en solo 4 años de desregulación y regulacion insuficiente
(2008 a 2010 y 2012, porque el 2011 no reportó ventas) alcanzaron la suma de Col$
59.985.222.880. Las de Risperdal en 5 años (2008 a 2012) Col$ 66.995.012.725, Nexium
Col$ 63.881.700.842 y Lipitor Col$ 50.162.439.333, para un acumulado de los 4 productos
de Col$ 241.024.375.780 en solo 3 años de desregulación (2008 a 2010) y 2 de regulación
insuficiente (2011 y 2012).
b) Los precios institucionales de los 4 productos intentaron ser regulados con VMR
"insuficiente" y luego PMV para indicaciones y concentraciones no incluidas en el POS. Uno de ellos fue inexplicablemente excluido de las listas de regulación.
c) La inclusión de sus principios activos al POS, constituye un mecanismo de regulación
indirecta, no porque efectivamente sirva para reducir los precios de las marcas pioneras y secundarias, sino porque direcciona el consumo institucional hacia las opciones genéricas (pocas EPS gastan sus recursos de UPC en artificios de marca).
d) El efecto de la inclusión de estos principios activos en el POS, no se refleja mayormente en
las ventas de marcas pioneras, porque los pacientes no aprovechan esta opción de acceso, tanto por el imaginario de mala calidad de los genéricos, como por la escasa o ninguna promoción de las EPS (cuanto menos se consuma, más mejoran sus estados financieros), la insuficiente difusión del gobierno y la escasa vigilancia de la Supersalud sobre los programas de promoción y prevención que deben adelantar las EPS.
e) Los precios reportados por las farmacéuticas en el canal comercial, confirman que son
ellas las principales responsables de los precios exorbitantes en las farmacias. Esto contradice claramente lo que afirman sus representantes, en sentido de que la responsabilidad de los precios perversos, es de la cadena de intermediación.
FigN°7: Precios Reportados, Encuestados y Regulados de NEXIUM 20 mg y LIPITOR 20 mg
En conclusión, está claro que al primer paso de la Circular 04 de 2013, deben seguirle más y mejores pasos, para rectificar rápidamente los PMV insuficientes y complementar el sistema con mecanismos de regulación indirecta más eficientes. No es justo decir que nada se hizo, pero es cierto que nada de lo hecho logró corregir el caos en los precios de las farmacias. Tampoco es cierto que toda la responsabilidad sea de los responsables de la regulación de precios, porque es evidente que muchas entidades dentro y fuera del gobierno, no están cumpliendo adecuadamente su labor.
6. Desafíos de la nueva regulación
6.1. David versus Goliat
Después de todo lo anterior, lo cierto es que los nuevos PMV comienzan afectando a 18 laboratorios que verán reducidas sus ganancias en una magnitud equivalente al ahorro del sistema (V. Las farmacéuticas que disfrutaron la anterior política de desregulación, recurrirán a toda su capacidad de argumentación y "lobby" para minimizar sus pérdidas y complicar la aplicación de la norma. El pequeño equipo de expertos de MinSalud, será sometido a un "bombardeo" de argumentos técnicos, de expertos -bien pagados y mejor dotados- de las farmacéuticas afectadas por la norma. Se cuestionarán las fuentes, se extremarán los argumentos y no faltará hasta quien se declare quebrado y obligado a retirarse del país.
Se magnificarán algunas inconsistencias que evidentemente tiene el borrador (very l. Es cierto que existen errores de digitación y un par de ellos influyen en el precio fijado y la estimación del impacto. Un producto cuyo CUM es del envase por 30 cápsulas, tiene PMV de una cápsula. Otro par, presenta error en la presentación. Pero, se trata de casos puntuales cuyo ajuste no debería cambiar lo central de la norma ni el estimado global de impacto. Falta ver cuál será el resultado final de la confrontación técnica entre David y Goliat.
6.2. Necesidad de un sistema de información más robusto
Las inconsistencias mencionadas en el párrafo anterior tienen relación con el grupo de 70 productos que están activos y tienen reportes de ventas a SISMED. En relación con los demás productos incluidos en el borrador, existen muchos inactivos y con errores poco relevantes. Estos errores (que seguramente servirán para que los interesados sugieran improvisación y precipitud de la norma) son transferencia de inconsistencias de las bases de datos del INVIMA y SISMED, que claramente juegan en contra y deberían obligar a medidas correctivas urgentes.
En efecto, para mostrar las limitaciones de la información del SISMED, digamos por ejemplo que: De los 26.961 registros que tiene el archivo del primer trimestre de 2013, solo 8.572 productos tienen datos reportados por los laboratorios en el canal comercial y solo 5.838 en el canal institucional. Al intentar un análisis por DCI (Denominación Común Internacional del Principio Activo) 310 registros presentan error con principio activo "Ioxitalámico Acido" y 442 registros simplemente no presentan datos de DCI o el código respectivo. En los archivos publicados, no aparecen datos de laboratorios o titulares de los registros sanitarios y el campo de presentación, claramente no está parametrizado.
En la información del SISMED hay suficientes inconsistencias como para suponer que no existe -o no funciona- un sistema de validación de datos. Algunos laboratorios reportan envases por canal comercial y unidosis por canal institucional, otros, reportan precios y cantidades irracionales, y otros -incluidas grandes multinacionales- muestran períodos donde simplemente dejaron de reportar. Claramente, el país necesita un sistema de información mucho más robusto, que permita detectar las inconsistencias, sancionar a los infractores y retroalimentar correctivos al INVIMA. Dada la magnitud de la tarea, en lugar de un reducido grupo de expertos, tranquilizaría ver algo parecido -por ejemplo- a las inmensas salas de computación que tienen las EPS solo para procesar sus recobros al sistema.
6.3. Ajustes a la base de datos y las funciones del INVIMA
Varios de los errores mencionados en los anteriores párrafos, provienen de inconsistencias de la propia base de datos de registros sanitarios del INVIMA (los datos de clasificación del principio
activo o DCI, errados o inexistentes, tienen ese origen). Pero las deficiencias del INVIMA van mucho más allá y tienen efectos más generales y a largo plazo:
- El INVIMA no publica la "información para prescribir" que publican otras agencias como la FDA, EMA, etc., por lo tanto es su responsabilidad que dicha "información para prescribir" esté capturada por las farmacéuticas y llegue a los médicos con adecuaciones de fondo y forma que inducen al uso de marcas comerciales de precios perversos. El INVIMA tampoco publica suficiente información de farmacovigilancia y no desarrolla campañas educativas entre los profesionales de la salud, por lo tanto, es también responsable de la persistencia de los imaginarios de mala calidad de los medicamentos genéricos, inexistencia de controles, e incluso aquel absurdo de que en Colombia todavía hay "laboratorios de garaje", cuando las exigencias de Buenas Prácticas de Manufactura (BPM) llevan más de una década de implementación total.
- El INVIMA no adelanta campañas educativas para los pacientes y ni siquiera se defiende adecuadamente de las acusaciones de algunos representantes de las farmacéuticas, que salen a cuestionar su trabajo y la calidad de los genéricos en Colombia sin mostrar el debido respaldo probatorio de sus afirmaciones. Dichas acusaciones, refuerzan el imaginario perverso -tan difundido entre algunos pacientes- de una supuesta mejor calidad de las "marcas". Y ese imaginario perverso, es fuente de millonarias ganancias, no solo para las farmacéuticas multinacionales, sino para algunas nacionales (y hasta algunas cadenas de droguerías con "marcas propias") que cobran precios elevados, en ocasiones tan exorbitantes como los "pioneros", solo por agregar un nombre de fantasía o "marca secundaria" a un producto básicamente genérico.
Es evidente un fortalecimiento reciente del INVIMA con inocultable apoyo de entidades norteamericanas, pero, al parecer, más para adecuar el país a las exigencias de los TLC, antes que para actividades en defensa de los intereses de la salud pública.
6.4. Que la Superintendencia de Industria y Comercio y la Supersalud
cumplan su labor
La Superintendencia de Industria y Comercio (SIC) en su página web dice estar facultada para iniciar investigaciones por violación del régimen de control de precios de medicamentos (artículo 34 de Circular 4 de 2006 y artículos 10, 11 y 12 del Decreto 2876 de 1984, Artículo 132 de la Ley 1438 de 19 enero de 2011), pero en la práctica, su accionar en el campo de la salud se limitó a sancionar algunos casos de publicidad engañosa. Sobre la barbarie de abusos con precios de medicamentos, puede decirse que el balance es de una inactividad casi total.
Y la Supersalud es directamente responsable de la vigilancia de las actividades de promoción y prevención que deben adelantar las EPS y el sistema en su conjunto. Si esta función se cumpliera mejor, muchos más pacientes estarían mejor informados y accederían más a los servicios a que tienen derecho. Tendríamos menos víctimas de la información asimétrica y los imaginarios perversos que solo sirven a los intereses comerciales de actores que se benefician con esta situación.
6.5. Necesidad de una visión macroeconómica
Atrapados como estamos aún en la contención de prácticas perversas que otros países ya superaron, no logramos incluir aún en el debate soluciones más estructurales como los mecanismos de compras centralizadas, una visión de largo plazo en el manejo de los temas de propiedad intelectual y el desarrollo de una política industrial dirigida a generar mecanismos alternativos de autoabastecimiento.
La falta de esta perspectiva macro está implícita en las críticas que en nombre de la sociedad civil hicimos al entonces proyecto de Circular 03 de 2013, específicamente sobre la eliminación del régimen de libertad regulada y la "dilución" de la función central que el régimen de control directo tiene en el manejo de las tendencias monopólicas de gran calado, como es el caso de los medicamentos Biotecnológicos.
En cuanto a los mecanismos de compras centralizadas, quedó históricamente demostrado que el modelo de intermediación con EPS, también ha sido perjudicial en este campo, porque no ha permitido desarrollar un sistema de este tipo, que hace parte estructural de la solución en otros países.
Y si en Colombia no fue posible desarrollar un modelo de compras centralizadas ¿qué podemos decir de una política pública dirigida al desarrollo de la industria nacional y el aseguramiento del autoabastecimiento?. La falta de discusión acerca de este tipo de políticas pareciera sugerir que la única política viable es la del libre comercio y la dependencia de productores y mercados internacionales. Esta falta de alternativas es particularmente preocupante en frente a la toma del mercado de genéricos por parte de multinacionales como Sanofi-Aventis que luego de comprar a una pequeña fabricante de genéricos en Antioquia, acaba de adquirir Genfar, la firma más emblemática del mercado de genéricos en el país. Si a esto sumamos que una firma chilena acaba de adquirir Lafrancol, que Procaps parece poco interesada en potenciar su línea de genéricos y que Tecnoquímicas también está profundizando su interés en marcas secundarias, el panorama para los medicamentos genéricos de la industria nacional y el autoabastecimiento es claramente sombrío.
Para terminar, digamos que este informe no pretende ser un estudio exhaustivo de la realidad colombiana en este campo. Se trata solo de un llamado a la moderación de posiciones retóricas, a una mejor contextualización de las medidas en marcha y a concentrar esfuerzos en la profundización de las medidas que efectivamente defiendan los intereses de la salud pública. FIN
Oscar Andia Salazar
Tatiana Andia Rey
Investigadora Asociada
Observatorio del Medicamento - OBSERVAMED Observatorio del Medicamento - OBSERVAMED
Federación Médica Colombiana
Federación Médica Colombiana
Envíe sus comentarios al correo
Autorización Para Reproducciones No Comerciales
Este informe puede ser impreso o reproducido por cualquier medio
para su utilización con fines de defensa de la salud pública
Federación Médica Colombiana
75 Años Defendiendo la Salud Pública y
el Ejercicio Etico de la Profesión Médica
Source: http://www.consultorsalud.com/sites/consultorsalud/files/OBSERVAMED%2520%2528Informe%2520borrador%2520Circular%252004%2520de%25202013%2520CNPMDM%2529.pdf
Agence PACA Etude d'incidence N° contrat : 20110337 EVALUATION DES INCIDENCES DU PROJET D'AMENAGEMENT D'UN RESERVOIR D'EAU POTABLE SUR LE SITE DE GARGALON A FREJUS AU REGARD DES OBJECTIFS DE CONSERVATION DES HABITATS ET DES ESPECES D'INTERET COMMUNAUTAIRE DU SITE NATURA 2000
VitalSmarts, Aorn, & AAcn present: The Silent Treatment Why Safety Tools and Checklists Aren't Enough to Save Lives David Maxfield, Joseph Grenny, Ramón Lavandero, and Linda Groah Silence Kills was conducted immediately before AACN's national standards for healthy work environments were released10. It identified seven concerns that often go undiscussed and contribute to avoidable medical errors. It linked the ability of health professionals to discuss emotionally and politically risky topics in a healthcare setting to key results like patient safety, quality of care, and nursing turnover, among others.







