Data0.eklablog.net
Pourquoi la maladie d'Alzheimer
est-elle si grave ?
Le dépistage de la maladie
A. Les différentes méthodesB. Le test RL/RI-16C. Statistiques et résultats
L'évolution de la maladie
A. La manifestation de la maladie, les premiers instantsB. L'aggravation de la maladieC. Le terme de la maladie
III- Comment lutter contre la maladie d'Alzheimer ?
A. Les différents traitementsB. Étude concrète des médicamentsC. Les nouvelles perspectives

La maladie d'Alzheimer est une maladie neurodégénérative (qui agit sur le fonctionnement du cerveau) qui provoque des lésions au cerveau. Elle a été décrite en 1906 par Aloïs Alzheimer qui donna son nom à la maladie. Cette maladie est donc une maladie dégénérative qui engendre un déclin progressif des facultés cognitives (mécanismes de la pensée) et de la mémoire. Les personnes peuvent penser, à tort, que ces symptômes font partie du processus normal de vieillissement. Ils sont souvent confondus avec les aspects normaux de la sénescence (vieillissement entraînant un
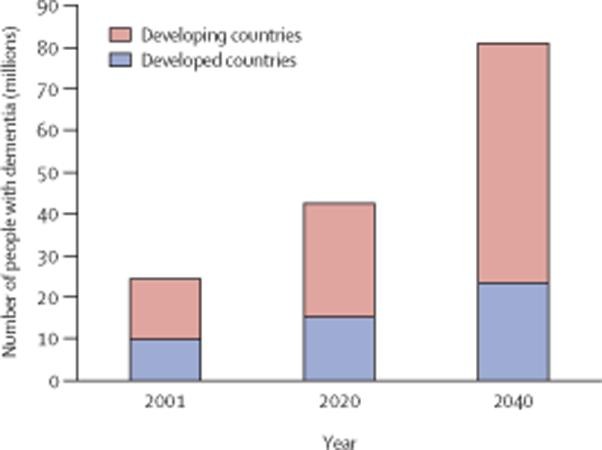
déclin lent des fonctions de l'organisme) ou d'autres maladies neurologiques. On ne sait pas encore guérir cette maladie. En revanche il existe des traitements capables d'atténuer la gravité des symptômes, et donc de freiner son développement. L'Alzheimer est généralement diagnostiquée à partir de l'âge de 65 ans. Elle est la principale cause de démence chez les personnes âgées : elle touche 26 millions de personnes dans le monde en 2005 et pourrait en toucher quatre fois plus en 2050 selon l'ouvrage « Global prevalence of dementia : a Delphi consensus study. ».
I – Le dépistage de la maladie d'Alzheimer
A-Les différentes méthodes
Afin de détecter si une personne est touchée par la maladie d'Alzheimer, il existe de
nombreuses techniques de dépistage. Il est cependant important de mentionner qu'un dépistage de la maladie d'Alzheimer n'est prescrit que dans des cas bien précis.
De ce fait, cette procédure est engagée seulement si le sujet est atteint des symptômes qui
caractérisent la maladie (entre autres la perte de mémoire, mais nous y reviendrons plus tard), et s'il est assez âgé. En effet, la maladie n'apparaît généralement pas avant 65 ans mais n'est cependant pas une conséquence normale du vieillissement. En effet, il existe une version précoce de la maladie d'Alzheimer, capable de se déclencher sur un individu de 30 ans.
Les différents facteurs:
Un facteur pouvant intervenir dans le développement d'Alzheimer est l'hérédité. Bien
qu'elles soient négligeables (les formes héréditaires ne concernent que 0.3 % des cas), elles restent encore incertaines mais font toujours l'objet d'études actuelles. Certains groupes de chromosomes sont aujourd'hui accusés de jouer un rôle dans le développement de la maladie, tels les chromosomes 1, 2, 14 qui ont récemment été individualisés. Mais ces particularités génétiques n'aboutissent pas au développement de la maladie, elles augmentent simplement le risque de la développer. Elles sont également un facteur des formes à début précoce. De plus, les personnes porteuses de trisomie 21 ont de fortes chances de développer la maladie d'Alzheimer. Des facteurs environnementaux peuvent être aussi en partie à l'origine de la maladie d'Alzheimer. Par exemple, la consommation excessive de viandes et de poissons constituerait un des facteurs. En effet l'accumulation d'agrégats de protéines jouerait un rôle dans le développement de la maladie. Cela expliquerait la hausse du nombre de cas développant la maladie d'Alzheimer qui correspondrait avec la hausse de consommation de viande dans le monde.
La prise de certains médicaments seraient aussi facteurs de développement de la maladie. Il
a aussi été démontré qu'une personne victime d'une blessure grave à la tête risque de développer la maladie d'Alzheimer. Ce risque augmente, si au moment de la blessure la personne a plus de 50 ans, qu'elle possède un gène spécifique (apoE4) et perd conscience juste après l'accident. L'apparition de maladies cardiovasculaires précoces peuvent être aussi un facteur de risque. L'alcoolisme est un facteur de risque avéré. Enfin, le tabagisme augmenterait aussi le risque de développement de la maladie.
Il est possible de dépister une démence si le cerveau comporte des anomalies qui la
caractérisent. On peut vérifier l'état du cerveau de différentes manières :
• L'Imagerie par Résonance Magnétique (IRM) permet de voir « à l'intérieur du cerveau » et
de rechercher une atrophie cérébrale (principalement de l'hippocampe). Cette méthode reste peu fiable puisque l'atrophie n'apparaît clairement qu'à un niveau avancé de la maladie ; de plus, l'atrophie n'est pas spécifique à la maladie d'Alzheimer car certaines dégénérescences cérébrales ont aussi de tels symptômes (Corps de Lewy, paralysie supranucléaire progressive.).
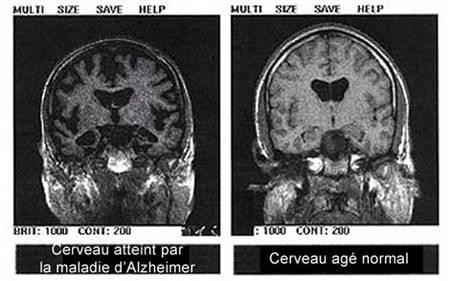
IRM d'un cerveau atteint et non atteint de la maladie d'Alzheimer
• On peut aussi diagnostiquer la maladie à l'aide d'un scanner cérébral qui est réalisé lorsque
l'IRM est contre-indiqué ou n'est pas réalisable. Le scanner ou tomodensitométrie (TDM) est basé sur le même principe que l'examen radiologique, mais l'image au lieu d'être fixée sur une plaque est reconstruite selon des plans choisis par informatique. Cette technique a le mérite d'administrer une dose moindre de rayons x et d'obtenir des images que la radiographie simple ne permettait pas de réaliser.
• On peut aussi faire des prise de sang afin de contrôler la quantité de vitamines B12 et B9. En
effet, une carence de ces vitamines peut être cause de démence.
D'autres examens sont réalisés dans certaines circonstances seulement :
• La tomographie à émission monophotonique (TEMP) est utilisée lorsque les données
cliniques ou d'imageries IRM ne suffisent pas à poser le diagnostic. C'est une technique d'imagerie médicale nucléaire tomographique basée sur la scintigraphie (utilisation d'isotopes radioactifs) et qui permet de réaliser des images et des reconstructions en trois dimensions des organes et de leur métabolisme à l'aide d'un ensemble de gamma caméras qui tournent autour du patient. Cette technique est surtout utilisée pour identifier les démences fronto-temporales.
• On peut également vérifier l'état cérébral en effectuant une ponction lombaire visant à
prélever du liquide céphalo-rachidien. C'est un liquide présent dans le cerveau qui amorti et absorbe les mouvements ou les chocs qui risqueraient d'endommager le cerveau. Il est également transporteur des « déchets » et des molécules provenant du cerveau. Suivant l'état de ce liquide, on peut savoir si l'appareil cérébral est atteint des symptômes de l'Alzheimer. Cette technique de dépistage est un appoint au diagnostic final.
Toutes ces méthodes sont radicales et leurs fiabilités sont parfois remises en question. Cependant, les experts s'accordent sur un fait : le meilleur moyen de dépister la maladie d'Alzheimer est de faire subir à l'individu un test cognitif. Ces tests se composent d'une suite de questions posées au patient, visant à détecter tout problème au niveau mémoriel.
Il existe notamment : les tests dits de QI qui ont pour objectif de rendre compte de l'état et des performances du cerveau (ex : test «des dominos»), et des tests plus spécifiques aux dégénérescences cérébrales. Parmi eux, le MMSE (MiniMental test) qui a longtemps été la référence des tests utilisés pas les médecins pour dépister une dégénérescence cérébrale.
MMSE: Le MMSE (Mini-Mental State Examination) ou Test de Folstein est un test rapide
permettant d'évaluer les capacités mnésiques (de la mémoire), très utilisé pour donner rapidement
au psychologue une idée de l'état cognitif du patient. Si le score est inférieur à 24, on peut suspecter
une démence. Ce test ne se suffit pas à lui seul, cependant, il est un point de départ à une évaluation
plus approfondie.
Ce test de référence est pratiqué lorsqu'on suspecte une démence ou pour permettre de suivre
l'évolution de la maladie. Il permet d'évaluer l'orientation spatio-temporelle, l'apprentissage, la mémoire, l'attention, le calcul, le raisonnement, le langage et les praxies constructives. L'entretien dure environ une quinzaine de minutes. En fonction du niveau socioculturel, l'évaluation est plus ou moins sévère.
Le score se calcule de la manière suivante: chaque question est notée 0 ou 1. La score total
varie de 0 à 30. Lorsque le score est supérieur ou égal à 28, le patient n'est pas atteint de démence. Lorsque le score est entre 24 et 27, il faut alors interpréter le résultat en fonction de l'âge et du niveau socioculturel du patient. Le diagnostic ne peut, après ce test, pas encore être établi. Une évaluation plus spécifique est souvent alors nécessaire si le patient présente des symptômes. Il est alors nécessaire de surveiller le malade. Lorsque le score est inférieur ou égal à 23, le patient est alors atteint d'un dysfonctionnement cognitif. Des examens supplémentaires sont nécessaires afin de comprendre la cause de ce dysfonctionnement.
Le MMSE reste le test le plus utilisé aujourd'hui mais d'autres existent, qui sont notamment
utilisés pour réaliser des études épidémiologiques ou non. Ils comprennent donc :
ADAS-Cog: L'ADAS-Cog (Alzheimer's Disease Assessment Scale) est une échelle élaborée en
1984 par Nathan Rosen (physicien qui travailla pendant de nombreuses années sur la mécanique
quantique, en collaboration avec Albert Einstein et Boris Podolsky).
Cette échelle permet d'évaluer les fonctions cognitives (contrairement à l'ADAS non cog)
des patients atteints de la maladie d'Alzheimer. Elle est souvent utilisée pour la recherche et les essais pharmacologiques comme outil de quantification.
Afin d'évaluer ses fonctions cognitives, le patient passe un entretien d'environ quarante-cinq minutes dans lequel on teste ses capacités sur onze items. Ces onze items testent mémoire, langage et praxie.
Le score peut varier entre 0 et 70. Plus le nombre d'erreurs augmente, plus le score est élevé.
Un individu sain aura un score entre 5 et 10. Si le score est de 70, le patient est atteint d'une démence sévère.
CIBIC-plus: Le CIBIC-plus (Clinican's Interview Based Impression of Change-plus) est une
échelle permettant au médecin de pouvoir émettre un jugement clinique sur un patient de façon
semi structurée dans un tableau à l'aide des informations que lui procurent les soignants du patient.
Le score va de 1 à 7. Un score de 4 signifie l'absence de modification. Un score inférieur à 4,
signale une amélioration. Un score supérieur à 4 souligne une aggravation.
PDS: La PDS (Progressive Deterioration Scale) est une échelle (validée par rapport à la Global
Deterioration Scale (GDS)) permettant d'évaluer les changements du patient dans ses activités
quotidiennes. Elle permet de suivre l'évolution de la démence et de déterminer à quel stade est le
patient. Elle est organisée en 29 items placés sur une échelle visuelle analogique avec deux réponses
possibles pour chaque items. Soit "absence de difficulté", soit "difficulté maximale". Ces items
permettent d'évaluer les aspects de la vie quotidienne du patient qui risquent d'être perturbés avec
l'évolution de la maladie: habillage, alimentation, autonomie ambulatoire, usage du téléphone,
notion du temps, de l'argent, conduite automobile, loisirs. Cette évaluation se fait pas une personne
s'occupant du patient à laquelle on demande de cocher les réponses correspondant aux capacités du
patient à accomplir les activités en question. Remplir l'ensemble de l'évaluation ne nécessite qu'une quinzaine de minutes. A partir des réponses on peut établir un score qui permet de quantifier le degré d'efficience du patient. Plus le score est faible, plus les capacités du malade sont réduites.
B- Le test RL/RI16
Les dernières recherches ont montré que le test MMS était insuffisant pour dépister
spécifiquement la maladie d'Alzheimer. Afin d'apporter une solution à ce problème, le test RL/RI16 fut conçu en 1987. Il permet de différencier la maladie d'Alzheimer des autres démences.
Aussi, lorsque l'on détecte un problème de mémoire sur un individu, on ne sait pas
précisément quel est le problème de mémorisation. En effet, il peut s'agir d'un problème d'encodage ou de récupération.
¤ L'encodage est le processus qui convertit un stimuli ou un événement en information stockée en mémoire. C'est la première étape du processus de mémorisation.
¤ La récupération suit l'encodage. C'est le processus qui permet d'aller rechercher l'information correcte dans la mémoire.
Le test RL/RI16 a la spécificité (contrairement à d'autres tests comme le MMS) de mesurer
les problèmes d'encodage en mémoire. Or la maladie d'Alzheimer est la seule démence liée à un problème d'encodage en mémoire. Donc le RL/RI16 est le seul test permettant de détecter précisément la maladie d'Alzheimer.
Le test est divisé en deux parties: la première a pour but de tester la mémoire immédiate (à
court terme), c'est l'étape d'apprentissage (rappel immédiat), la seconde pour tester la mémoire à plus long terme, c'est l'étape de mémorisation (rappel différé).
Tout d'abord l'étape d'apprentissage consiste à montrer une liste de cinq mots et à demander
à l'individu testé de lire la liste des mots à haute voix et d'essayer de les retenir. Puis demander à cet individu d'associer un des mots de la liste à une catégorie imposée par le médecin.
Exemple: Une boisson → la limonade.
Reprendre et cacher la liste des mots et redemander au patient les cinq mots de celle-ci. En
cas d'oubli et seulement pour les mots oubliés, redemander le mot associé à la catégorie que vous rappellerez.
Exemple: Quel est le nom de la boisson?
Comptez alors les bonnes réponses (avec ou sans indice). Le score sera sur cinq points, un
point par mot rappelé. Si le score est inférieur à cinq, montrer à nouveau la liste de cinq mots et rappeler les catégories et les mots oubliés. Si le score est égal à cinq, l'enregistrement des mots à été effectué. On peut alors passer à l'épreuve de mémorisation.
Cette seconde étape consiste à vérifier si l'individu retient les mots à plus long terme. Il faut
tout d'abord détourner l'attention de l'individu pendant trois à cinq minutes. Pour cela, il, existe plusieurs techniques. On peut par exemple demander à l'individu de décompter de sept en sept à partir de cent.
Exemple: 100-7=93 ; 93-7=86 ;.; 9-7=2.
On demande ensuite à l'individu de réciter les cinq mots de la liste initiale. Pour les mots
oubliés, redemander le mot associé à la catégorie que vous rappellerez, comme dans la première étape.
Cette étape, tout comme la première, est notée sur cinq points avec un point par mot rappelé. le score total est sur dix. Dès qu'un des mots a été oublié, il existe un trouble de mémoire.
C. Statistiques et résultats
Quelques chiffres concernant la maladie d'Alzheimer:
• En France: 860 000 personnes souffrent de la maladie d'Alzheimer. Aux États-
Unis on compte 4,5 millions de personnes. A l'échelle mondiale, on compte 36
millions de personnes dans le monde atteintes d'Alzheimer ou de troubles
apparentés.
• 10.000 nouveaux cas par an en France
• La maladie d'Alzheimer voit sa fréquence passer de 4,1% entre 75 et 79 ans à
40% après 90 ans.
• Elle est plus fréquente chez la femme en raison de sa plus grande longévité de vie
(17,2%) que chez l'homme (9,1%).
• Sur 160 000 démences, on peut compter 110 000 cas de maladie d'Alzheimer,
soit environ 65% des démences.
• 70 à 80% des malades vivent en institution.
• L'évolution naturelle de la maladie vers la mort est de 8 à 10 ans.
• C'est une maladie coûteuse: En France, pour 430 000 malades le coût est de 8
milliards d'euros par an. de 8 milliards d'euros par an, aux USA le traitement
d'un malade coûte 21.500 € par an.
• C'est une maladie qui n'est pas suffisamment diagnostiquée: La maladie
d'Alzheimer n'est diagnostiquée en France que chez 50 % des patients atteints.
Dans le cadre de notre TPE, nous avons réalisé une série de test RL/RI16 sur des personnes d'âge plus ou moins différent, bien que nous ayons principalement profité de nos connaissances et que les résultats étaient connus d'avance.
– Entre 15 et 18 ans : 9 personnes interrogées, 9 avec un score de 10.
– Entre 30 et 55 ans : 7 personnes interrogées, 6 avec un score de 10 et 1 avec un score de 8,
même si cela n'est pas significatif.
II- L'évolution de la maladie
A- La manifestation de la maladie, les premiers instants.(Stade léger)
La maladie d'Alzheimer connaît une évolution dans sa gravité, les dégâts qu'elle cause étant
de plus en plus importants au cours du temps. Elle se développe, s'impose et s'installe davantage dans la vie du malade, le touchant de l'échelle moléculaire à l'échelle du déroulement de sa vie.
Cette aggravation se fait en plusieurs étapes, débutant de la déclaration de la maladie au décès qui reste encore aujourd'hui inévitable. Attardons nous tout d'abord sur les premiers instants de la maladie.
Ces premiers instants forment une phase silencieuse, invisible, durant laquelle les premières
lésions apparaissent. Localisées principalement dans le cortex (couche externe des deux hémisphères du cerveau) d'une zone du cerveau appelée Hippocampe, région cérébrale qui joue un rôle primordial dans le processus de mémorisation. Lorsque les lésions ont atteint une certaine intensité, les signes cliniques font leur apparition.
Les premiers symptômes sont superficiels et souvent confondus avec ceux d'autres pathologies car ils ne sont pas spécifiques à la maladie d'Alzheimer. Ceux-ci se caractérisent par :
– Une perte de mémoire bénigne qui se manifeste par une impossibilité de mémoriser des
– Des modifications du comportement, notons ici principalement une baisse de motivation
et d'intérêt pour des actions courantes, ainsi que des perturbations affectives (irritabilité accrue) et un repli du malade sur lui-même.
– Une perte de la notion de la valeur de l'argent, ou bien des difficultés à s'orienter.
– Premières difficultés pour s'exprimer, le malade manque parfois de mots pour se faire
Pourtant le malade se rend toujours compte de ses actes, et bien que des oublis se
manifestent, il préfère nier ses symptômes lorsqu'ils apparaissent. Il garde cependant une activité globalement autonome.
B- L'aggravation de la maladie. (Stade modéré)
L'évolution de la maladie conduit l'individu malade vers un second stade, dit modéré. Ce
stade peut durer entre 2 et 6 ans selon la rapidité de la progression de la maladie qui varie en fonction des individus. Cette phase de la maladie présente des symptômes propres à Alzheimer contrairement au premier stade. La perte d'autonomie est significative et la présence d'une aide au quotidien devient alors indispensable pour gérer la vie de tous les jours. Les troubles s'aggravent et le patient n'en est plus conscient : il nie ou sous-estime ses difficultés (anosognosie). Ses repères spatio-temporels disparaissent. Il ne reconnaît plus les objets usuels, son environnement devient source d'accident. Son discours devient incohérent et son langage se détériore. Une modification de la personnalité est souvent observée : agressivité, perte d'intérêt, trouble du sommeil, de l'alimentation. Enfin, il est difficile pour le malade de reconnaître ses proches.
Jusqu'à maintenant, nous avons réalisé une description clinique de la maladie d'Alzheimer.
Mais ces troubles cognitifs sont liés à des lésions neuronales. En effet, le cerveau du patient est victime d'un double processus de dégénérescence et d'inflammation. On peut relever deux types de lésions qui participent à un endommagement plus global du cerveau: L'apparition de plaques séniles
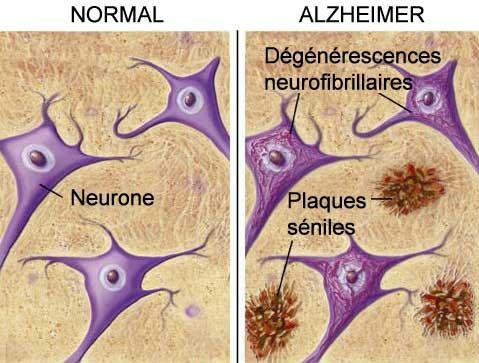
et des dégénérescences neurofibrillaires.
Tout d'abord, le développement de la maladie débute avec l'apparition de plaques
amyléoïdes, dites séniles, à l'intérieur du cerveau. Elles sont essentiellement localisées dans le néocortex et l'hippocampe. Elles correspondent à l'accumulation de peptides (polymère d'acides aminés reliés entre eux par des liaisons peptidiques) dits "β-amyloïde" ou "Aβ42". Ces plaques s'accumulent et compriment les neurones ce qui à terme entraîne la destruction de neurones (d'où une réduction visible du cerveau). La protéine β-amyloïde est une protéine "anormale" et pathogène (neurotoxique) néfaste pour le système nerveux. Le dysfonctionnement de cette protéine résulte d'une mauvaise transformation d'une glycoprotéine membranaire (APP: Amyloïd Protein Precursor, protéine précurseur de la protéine β-amyloïde). Cette anomalie permettrait une entrée anormale de calcium dans le neurone ce qui entraîne sa destruction (névrose ou apoptose).
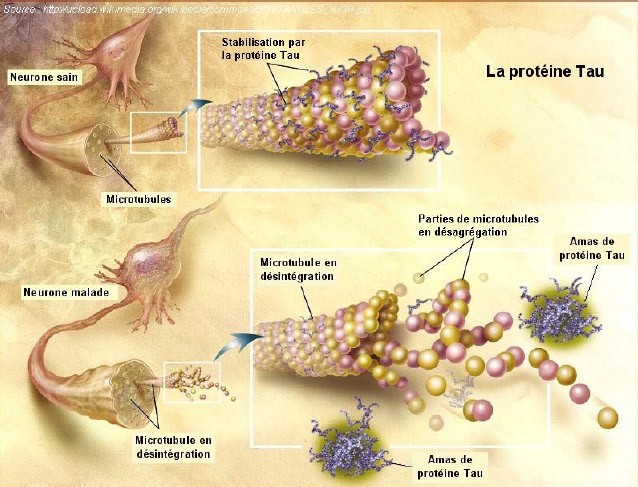
La maladie est aussi caractérisée par le développement de dégénérescences neurofibrillaires
dues à un dysfonctionnement de la "protéine Tau". Cette protéine est située dans les neurones. Elle module la stabilité des microtubules, (Les microtubules sont impliqués dans la formation de la plaque équatoriale et le déplacement pôlaire des chromosomes pendant la mitose), à l'intérieur des axones (fibres nerveuses qui sont le prolongement du neurone qui conduit le signal électrique du corps cellulaire vers les autres neurones). Si ces microtubules ne sont pas régulés et stabilisés par la protéine tau, ils se désintègrent. Ainsi, le noyau ne reçoit plus les substances nécessaires à son fonctionnement et finit par mourir.
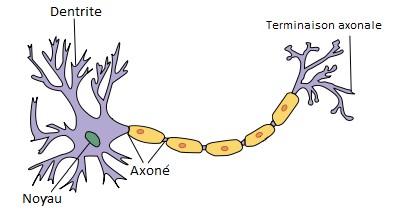
Schéma d'un neurone
On a observé précédemment que l'apparition de plaques séniles entraînait une réduction
visible du cerveau. Ce phénomène se nomme "l'atrophie corticale". Elle consiste à la perte de poids du cerveau de 8 à 10% tous les 10 ans (2% seulement pour une personne saine). Elle s'accompagne d'une dilatation des ventricules cérébraux (Cavités situées dans l'encéphale (système nerveux compris dans le crâne) et contenant du liquide céphalo-rachidien) et des sillons corticaux et d'une perte neuronale qui affecte le système cholinergique (amygdales, hippocampe, septum.).
Sur le schéma ci-dessus, on peut voir que les neurones utilisés pour le langage et la mémoire
sont moins nombreux chez un sujet atteint et que la surface occupée par ces aires dans son cerveau diminue.
On peut donc dire que la maladie se manifeste à travers:
- Le milieu intracellulaire: dégénérescences neurofibrillaires- Le milieu extracellulaire: plaques séniles.
Cependant les origines de la maladie d'Alzheimer demeurent inconnues. On a avancé de
nombreuses théories, mais aucune d'entre elles n'est totalement satisfaisante ou vérifiée. On connaît, grâce à de nombreuses études, quelques facteurs de risques mais les causes elles-mêmes sont encore, jusqu'à ce jour, difficiles à identifier.
C- Le terme de la maladie. (Stade sévère et terminal)
Comme nous l'avons vu auparavant, la maladie d'Alzheimer connaît une aggravation notable
qui se termine par une dernière phase constituée du stade sévère et terminal. Tout d'abord, le stade sévère s'installe sur une période qui peut évoluer entre deux et quatre ans et les malades souffrent de démence sévère. Les fonctions cognitives ont presque totalement disparues. Le patient perd la capacité de comprendre ou d'utiliser le langage et risque de répéter la fin des phrases sans comprendre le sens des mots. Son discours devient incohérent. De plus, il oublie des événements de sa vie. La dégénérescence nerveuse entraîne la réapparition de certains réflexes archaïques (gestes innés du nouveau-né à la naissance) ainsi qu'une incontinence urinaire et fécale. Les malades peuvent devenir agressifs, exigeants, voire violents ou asociaux. D'autres sont, au contraire, très dociles et dépendants. Les nombreux troubles physiques entraînent un placement en institution quasi-obligatoire.
Le stade terminal se caractérise par une incontinence totale qui s'ajoute à une incapacité de
marcher, de s'asseoir, de sourire et d'avaler. Il dure en moyenne deux ans durant lesquelles l'individu perd toute son autonomie. Il est alors par la suite dans un état grabataire qui l'empêche de quitter son lit. Une fois alité, il risque d'attraper des escarres (lésions cutanées) si on ne le change pas de position régulièrement. Il devient raide, ne réagit plus aux stimuli et peut être agité et irritable. Une surveillance constante est clairement nécessaire à ce stade. Cependant, malgré la sévérité des symptômes, le patient réagit bien au toucher et aux voix familières et douces. La mort du patient est souvent entraînée par une grande fatigue, une perte de poids considérable ou des infections bronchiques. Le patient meurt généralement huit à douze ans après le diagnostic de la maladie.
III Comment lutter contre la maladie
A – Les différents traitements
Actuellement, les données scientifiques permettent d'identifier des pistes thérapeutiques de
la maladie d'Alzheimer. Les dégénérescences neurofibrillaires ou DNF (altération de la structure des neurones, secondaires à une hyperphosphorylation (= saturation dans le fonctionnement hormonal suite à un développement excessif de l'apport en phosphore) des protéines tau (= protéines impliquées dans le transport axonal)) et les plaques amyloïdes (accumulation de peptide amyloïde libéré) sont donc les principales lésions. À 50 ans environ, la moitié de la population générale présente déjà des DNF dans leurs zones temporales internes ce qui veut dire que les lésions débutent tôt dans la vie. Résultant des déficits biochimiques cholinergique, glutamatergique, sérotominergique, somatostatinergique … les symptômes apparaissaient la plupart du temps après 80 ans, soit tardivement après l'apparition des DNF car les processus cérébraux de compensation maintiennent une fonction normale pendant quelques décennies : c'est une phase asymptomatique. Toujours au stade de recherche, les approches thérapeutiques d'aujourd'hui visent à s'attaquer au processus pathologique de la maladie, soit les déficits biochimiques identifiés. Symptomatique et d'une efficacité restreinte, les médicaments visent à limiter les symptômes bien qu'ils ne s'attaquent pas directement à la source de ses derniers. Toutefois, plusieurs médicaments sont en cours de développement et sont porteurs d'espoir. Les perspectives (Les médicaments de demain) notamment, cherchent à bloquer directement la maladie en agissant soit sur le système amyloïde (par inhibition des sécrétases ou par destruction des plaques séniles (vaccin)) soit sur les dégénérescence neurofibrillaires (par inhibition de phosphorylation anormale des protéines tau), la source directe du mal, si l'on peut le dire ainsi.
N'étant pas ciblés sur les mécanismes cellulaires de la maladie (la production de B-
Amyloide liée aux plaques séniles, ou les protéines tau), c'est-à-dire qu'ils ne peuvent s'attaquer aux causes du mal; ces traitements permettent cependant de ralentir le développement des symptômes du patient sur le long terme et peuvent ainsi agir sur les troubles cognitifs et comportementaux associés à la maladie d'Alzheimer.
Il n'existe donc pas à ce jour de traitement capable de stopper la maladie d'Alzheimer.
Les traitements ont un apport bénéfique plutôt faible n'empêchant pas la maladie d'évoluer,
et selon les médecins, ils sont efficaces après plusieurs mois (3 à 6 mois). Actuellement, un malade sur trois environ est traité en France, ce qui est plus que le reste de l'Europe, comme nous le montre le graphique ci-dessous :
Source : GALLEZ C. (Députée), La prise en charge de la maladie d'Alzheimer et des maladies apparentées, Rapport de l'Office parlementaire d'évaluation des politiques de santé (OPEPS), p.93.
Quatre médicaments sont commercialisés en France, donc disposent d'une autorisation de
mise sur le marché (AMM), délivrés sous ordonnance. Il faut parfois plusieurs mois pour savoir lequel des médicaments convient le mieux au patient. Selon les études, après 1 an de médication, 40 % des gens voient leur état s'améliorer, 40 % ont un état stable et 20 % ne ressentent pas d'effet.
On peut classer ces 4 médicaments en deux familles : Les inhibiteurs de la cholinestérase
(= anticholinestérasique AchE) et les antiglutamates.
Inhibiteurs de la cholinestérase :
Les lésions du cerveau, caractérisées par la formation des plaques amyloïdes ainsi que les
dégénérescences neurofibrillaires sont caractéristiques de la maladie d'Alzheimer et sont
accompagnés d'une diminution de la quantité d'Acétylcholine contenue dans le cerveau.
L'acétylcholine Ach est un neurotransmetteur indispensable au bon fonctionnement de notre
cerveau, capital pour notre mémoire et notre apprentissage. En effet, il permet la transmission de
l'influx nerveux entre les neurones. Il est également impliqué dans le système nerveux périphérique,
qui concerne notamment l'activité musculaire et les fonctions végétatives.
On a relevé que les personnes atteintes de la maladie d'Alzheimer ont une quantité
d'Acétylcholine dans le cerveau plus faible qu'une personne non atteinte, car la destruction des cellules nerveuses réduit la production de l'Acétylcholine. Le déficit biochimique qui est ici concerné est le déficit cholinergique.
Ainsi les anticholinestérasiques empêchent la dégradation des molécules dans la fente synaptique et aide à augmenter la concentration en Acétylcholine dans certaines régions du cerveau (soit ils empêchent leur destruction). Ils empêchent le cholinestérase de détruire l'acéthylcholine mais aussi augmentent la réactivité des récepteurs afin qu'ils réagissent à des quantités moindres d'acétylcholine. Ces médicaments sont symptomatiques : ils n'agissent pas sur les causes de la maladie et les processus par lesquels ces causes agissent, mais sur le déficit cholinergique qui résulte des conséquences de la perte d'une des classes de neurones touchées.
Ils sont principalement utilisés pour les formes légères ou modérés.
Schéma du fonctionnement d'un anticholinestérasique
Bien qu'il n y a pas d'améliorations significatives en terme de mémoire, l'entourage du
patient constate souvent une amélioration plutôt globale, au niveau de leur comportement et de leurs gestes quotidiens.
Les inhibiteurs de cholinestérase sont constitués de 3 médicaments d'un effet plutôt égal.
> Aricept® (Principe actif = donépézil ou E2020) Il permet d'atténuer les symptômes légers,
modérés et avancés de la maladie. Il est vendu sous forme de comprimés. (1 prise par jour, à 5 puis
10 mg)
Molécule de Donépézil
> Exelon® (Principe actif = Rivastigmine) La rivastigmine est un inhibiteur cholinestérase qui
inhibe l'acétylcholinestérase mais également la butyrylcholinestérase contrairement au donépézil et
à la galantamine. Durant 24h, l'organisme absorbe lentement le médicament qui est sous forme de
timbre cutané ou patch. La rivastigmine est proscrit pour des patients qui ont des symptômes légers
ou modérés. Il est également utilisé pour la maladie de Parkinson. (2 prises par jour, à 1,5 puis 3
mg, dose qui peut être augmentée jusqu'à une posologie quotidienne totale de 12 mg)
Molécule de rivastigmine
> Reminyl® (Principe actif = bromhydrate de galantamine) Il est vendu sous forme de comprimé
pris 1 fois par jour dans le cas de symptômes légers ou modérés.(2 prises par jour, à 4 puis 8 mg,
jusqu'à une dose quotidienne totale de 24 mg ; ou sous forme LP avec 1 prise par jour)
La galantamine est un alcaloïde (molécule/substance organique d'origine végétale) tertiaire isolé des Amaryllidaceae (ex : jonquille et perce-neige). Elle a par ailleurs une action modulatrice allostérique sur les récepteurs nicotiniques. Le Reminyl est le dernier médicament anticholinestérasique commercialisé pour la maladie d'Alzheimer.
Molécule de galantamine
> Cognex® (Principe actif = tacrine) Quand à la tacrine, elle est aussi un inhibiteur de la
cholinestérase mais un peu à part. Indiqué dans le traitement symptomatique des formes légères à
modérées, elle est présentée sous forme de gélules. Le Cognex n'est pas approuvé dans certains pays
(Canada, .) car elle peut être employée dans le dopage sportif et peut occasionner des effets
secondaires plutôt graves comme surtout un risque d'hépatotoxicité. Il reste tout de moins un
médicament contre la maladie d'Alzheimer utilisé aux États-Unis.
Molécule de tacrine
Les neurones produisant de moins en moins d'acétylcholine, les médicaments perdent donc
de l'efficacité avec le temps. Il est également important de revoir son médecin régulièrement car ils peuvent entraîner des effets secondaires lié à leurs propriétés cholinergiques, surtout lors d'un surdosage. (Comme exemple : crampe musculaire, vomissement, nausée, trouble digestif, fatigue, diarrhées ou même encore une perte d'appétit et de motivation). C'est pourquoi il est recommandé aux personnes âgées de faire un électrocardiogramme avant le commencement du traitement. Le médecin pourra donc instaurer un traitement croissant et ajuster la dose du médicament au besoin.
Les antiglutamates :
Cette famille ne comporte qu'un seul médicament et est apparu en 2002. Ce dernier est
prescrit pour un traitement symptomatique des stades modérément sévère à sévère. La molécule de glutamate (ou forme ionisée de l'acide glutamique) est un des neurotransmetteurs excitateur les plus importants dans le système nerveux central. Elle est responsable d'une excitation toxique de ce dernier. Lorsque la concentration en glutamate est trop excessive dans la fente synaptique, il va tellement stimuler les neurones qu'il provoquera leur mort. Présent en grande quantité dans l'environnement des neurones, il contribue donc à la maladie d'Alzheimer en détruisant ces derniers. La mémantine prend ainsi la place du glutamate.
Schéma de l'action du glutamate
Les antiglutamates bloquent donc les récepteurs du glutamate (appelés aussi récepteurs
NMDA > N-méthyl-D-aspartate) qui sont situés sur les neurones du cerveau en se fixant sur eux afin de retarder la perte des fonctions cognitives. Ils peuvent d'ailleurs les améliorer parfois chez certains patients. Comme les inhibiteurs de cholinestérase, il n y a pas d'amélioration significative mais l'entourage remarque souvent une amélioration globale sur les activités quotidiennes et les troubles du comportement du patient. De plus, la mémantine semble être bien tolérée par les malades bien que rien n'indique qu'elle ralentisse la dégénérescence des neurones.
> Ebixa® (principe actif = mémantine). Prescrit chez les patients pour soulager les symptômes
modérés à graves de la maladie donc, il est vendu sous forme de comprimés pelliculés. Pendant ou
en dehors des repas, il doit être administré une fois par jour et à la même heure.
Molécule de mémantine
Seuls les neurologues, les psychiatres et les gériatres peuvent prescrire ces 4 médicaments
contre la maladie d'Alzheimer. Les médecins généralistes eux, peuvent seulement renouveler l'ordonnance du malade. Un inhibiteur de cholinestérase peut être couplé avec un antiglutamate car
leurs effets et leur mode d'action sont différents, cela ne perturbe donc en rien leur efficacité. De plus, les médecins sont fréquemment amenés à prescrire des traitements comportementaux non spécifiques à la maladie d'Alzheimer (co-prescription) notamment lorsque le patient présente des troubles de dépression, d'hallucinations … En outre, près de 40% des malades sous « anti-Alzheimer » bénéficient d'un traitement antidépresseur, estime La Haute Autorité de Santé (HAS). Ainsi, les co-prescriptions seront le plus souvent des antidépresseurs, des neuroleptiques ou des psychotropes. Bien heureusement, ces traitements sont pris en charge à 100% en tant que « Affection longue durée » (ALD).
Aucun de ces traitements ne stoppe, ni même ne ralentit l'évolution de la maladie
d'Alzheimer, mais ils améliorent grandement les conditions de vie du malade. L'entourage peut donc le prendre en charge plus confortablement. D'ailleurs, l'entourage est un élément très important et même essentiel, considéré comme une composante du traitement. Aujourd'hui, six malades sur dix sont à la charge de leur famille. Elle permet en plus de tenir le médecin informé de l'avancement du traitement et de la pathologie du patient ainsi que de ses réactions. Cela s'avère plutôt indispensable en cas de prescription d'un nouveau traitement. Le rôle de l'entourage est d'ailleurs stratégique, en accord avec le médecin , il aide le patient de diverses façons : visites régulières pour apporter du soutien, s'assurer que l'environnement du malade ne comporte pas de danger, fournir des aides-mémoires et notamment un papier ou bracelet que le malade porte toujours muni des numéros de téléphone essentiels …
De plus, les approches non médicamenteuses peuvent compléter le traitement afin de
stimuler les capacités que dispose encore le malade. Redonnant souvent une plus grande confiance en soi, elles agissent sur les déficiences du patient dans le but de maintenir son autonomie, outre les avantages psychologiques.
Réhabilitation et rééducation cognitives prouvent aussi leur efficacité notamment avec la
stimulation des fonctions intellectuelles (exercices de mémoire, de raisonnement), développement de l'autonomie et de l'adaptation, orientation dans la réalité, dans les relations et même kinésithérapie.
Outre ces approches qui peuvent se faire tant en hôpital (réadaptation et accueils
thérapeutiques compris) qu'à domicile, les médecins encouragent également et même fortement le malade à faire de l'exercice physique. En effet ce dernier est très bénéfique pour un malade atteint de la maladie d'Alzheimer. Il donne une impression de but, d'objectif, il maintient en forme autant pour l'équilibre, l'énergie et le dynamisme et ainsi rend moins fragile le patient qui conservera mieux ses capacités motrices. Évidemment, l'exercice, comme pour toute personne améliore l'endurance, la force, l'humeur, la santé (circulation sanguine, rythme cardiaque …).
En fin de compte, le traitement (médicamenteux et non médicamenteux) doit être adapté aux
besoins caractéristiques et spécifiques de chaque malade.
B – Étude concrète des médicaments
Voyons un médicament et sa boite de plus près.
Le Reminyl (PA = Galantamine):
Il appartient à la classe thérapeutique « neurologie-psychiatrie », plus précisément des
anticholinestérases. La galantamine n'appartient pas à la famille des Stigmines contrairement à la Rivastigmine. Composé de toute une liste d'excipients : Phtalate de diéthyle, éthylcellulose, hypromellose, macrogol 400, amidon de maïs, saccharose. L'enveloppe de la gélule, elle, est constituée de : gélatine, dioxyde de titane (E171), oxyde de fer rouge (E172) (gélules de 16 et 24 mg), oxyde de fer jaune (E172) (gélules de 24 mg), encre d'impression.
Son excipient à effet notoire reste le saccharose et les gélules sont des gélules à « libération prolongée ». Cela signifie qu'elles libèrent le médicament plus lentement.
Il est évidemment soumis à des prescriptions médicales et le diagnostic de démence doit être préalablement confirmé conformément aux critères cliniques.
La posologie (8mg/jour soit 2 prises de 4mg) doit être réévalué à intervalles de temps réguliers de 3 mois au début. Une augmentation de la dose est envisageable ensuite jusqu'à 16mg/jour (8mg de fois par jour) et jusqu'à 24 mg/jour (12 mg 2 fois par jour).
Le médicament n'est évidemment pas recommandé pour les enfants.
Tous les médicaments pour la maladie d'Alzheimer sont de niveau 2 et possèdent sur leur emballage le pictogramme suivant :
Il faut ainsi examiner au cas par cas, avec son médecin, si la prise du médicament est
compatible avec la conduite, car elle entraîne sur la plupart des personnes des effets négatifs qui compromettront donc une conduite normale.
Il est également disponible sous forme de comprimé (4mg, 8 mg et 12 mg) et de solution buvable (4mg/ml).
L'efficacité de la galantamine a été démontrée à l'aide des 3 outils d'évaluation utilisés en
étude. Ainsi, à l'aide de l'échelle de l'ADAS-cog, de l'échelle CIBIC-Plus et l'échelle NPI (Inventaire Neuropsychiatrique, échelle de mesure des troubles du comportement)
Cette étude en double-aveugle contrôlée placebo nous montre que l'effet symptomatique de la galantamine est bénéfique pour les personnes atteintes de la maladie d'Alzheimer et l'est d'autant plus que la dose est importante.
Inhibiteurs de la cholinestérase :
Leur efficacité :
L'efficacité des IAChE s'évalue en prenant en compte plusieurs éléments (échelles utilisées
pour mesurer les résultats, le manque d'étude des impacts socio-économiques, essais publiés restreints limitant l'exploitation et l'imprécision concernant les effets secondaires …) bien que la pertinence des échelles reste à démontrer : le lien entre efficacité clinique (efficacité du médicament) et résultats statistiques est difficile à considérer. Les petites variations obtenues selon les différentes études ne doivent pas être forcément perçues comme ayant une pertinence clinique car les essais concernant la maladie d'Alzheimer emploient des variables aux amplitudes importantes.
L'effet bénéfique des médicaments (soit des molécules) sur les symptômes cognitifs a aujourd'hui été montré par des études randomisées (statistique et échantillon) utilisant la technique du « double aveugle, contrôlée versus placebo ». Il est surtout établi à l'aide de trois outils d'évaluation indépendants et spécifiques. Chacun d'un domaine particulier, ils sont principalement utilisés à des intervalles réguliers au cours de périodes de traitement de 6 mois. Ils comprennent donc :
L'ADAS-Cog : (une mesure de la performance cognitive) Alzheimer's Disease Assessment Scale.
La CIBIC-Plus : (une évaluation globale du patient par le médecin incluant des données recueillies
auprès de la personne aidante)
La PDS : (une évaluation réalisée par la personne aidante, des activités de la vie quotidienne,
incluant l'hygiène personnelle, l'autonomie, notamment pour se nourrir, s'habiller, les occupations
domestiques telles que les courses, le maintien de la capacité à s'orienter dans différents
environnements ainsi que l'implication dans des activités en rapport avec l'argent, etc.)
Le MMSE (Mini-mental state examination : test rapide permettant d'évaluer les capacités
mnésiques notamment, très utilisé pour donner rapidement au psychologue une idée de l'état du
patient).
Ainsi, le bénéfice thérapeutique a été confirmé dans plusieurs études, notamment par la
méta-analyse de Cochrane réalisée sur 13 études randomisées où le bénéfice thérapeutique était de 2,7 points sur l'échelle de l'ADAS-cog et de 1,4 points du MMS contrairement au groupe placebo. Celle-ci a également démontré l'effet bénéfique sur les activités et le comportement dans la vie quotidienne du patient. D'autres ont montré que l'efficacité se maintenait sur plusieurs années (entre 2 à 5 ans).
Globalement, les études montrent une amélioration sur l'échelle de la vie quotidienne et
parfois sur la NPI (Le NPI est un inventaire de 12 symptômes parmi les plus fréquents au cours de la maladie d'Alzheimer et des maladies apparentées, qui évalue leur fréquence et leur sévérité, ainsi que le retentissement sur l'aidant ou le professionnel) lorsque le patient est sous IAChE. En outre, les IAChE on un effet favorable sur le fardeau de l'aidant et le temps d'aide. Mais leur efficacité est au mieux modeste et de pertinence clinique discutable. En effet, aucun impact n'a été démontré sur le délai d'entrée en institution, la qualité de vie ou la morbi-mortalité (mortalité due à une maladie, ici celle de l'Alzheimer).
Il n y a pas de différence notable entre l'efficacité des 3 molécules utilisées comme
inhibiteur de cholinestérase.
Leur efficacité selon les stades:
Les IAChE sont efficaces aux stades léger et modéré de la maladie d'Alzheimer. Mais nous
n'avons pas démontré qu'ils le sont au stade sévère. Il a tout de même été démontré pour chaque IAChE que, dans les études randomisées en double aveugle contre placebo, les patients mis d'abord sous placebo, lorsqu'ils reçoivent un traitement, ne rattrapaient pas les résultats des patients qui avaient reçu un traitement dès le départ. D'où l'intérêt d'un traitement et d'un dépistage tous deux précoces.
Pour des raisons éthiques, les études ne peuvent pas dépasser 1 an lorsque le patient est sous
placebo. Mais une étude non randomisée a tout de même été réalisée : un groupe de patients sous IAChE a été comparé à un groupe non traité, tous deux suivis pendant trois ans. Après ces trois ans, le risque d'entrer en institution passait de 40% pour les malades non traités à 6 % pour les malades traités. Dans la mesure où cette différence peut être liée à une prise en charge ou une surveillance plus étroite, l'efficacité des traitements à long terme (ou long cours) ne peut donc pas être établie bien qu'on s'appuie sur les études faites à moyen terme.
Finalement, les IAChE ont changé l'image de la maladie. Le diagnostic est établi plus tôt et
plus souvent qu'avant grâce à leur prescription. Ils ont engendré une meilleure organisation des soins en impliquant les médecins dans la prise en charge globale des patients. Ils permettent également d'anticiper l'arrivée des traitements de demain. La communauté scientifique fonde notamment beaucoup d'espoir sur les traitements à visée éiopathologénique (quelques-uns, préventifs, sont en phase 3 de développement).
Les antiglutamates :
Leur efficacité :
Antagoniste des récepteurs NMDA, la Mémantine dispose d'un mécanisme (ou forme)
d'action encore discutée. La molécule de glutamate (ou forme ionisée de l'acide glutamique) est un des neurotransmetteurs excitateur les plus importants dans le système nerveux central. Son activité est associée au concept d'excitotoxicité : la destruction des neurones est une conséquence de l'hyperactivité des récepteurs NMDA. L'efficacité de la Mémantine est pourtant liée à une action symptomatique dont le mécanisme reste mal connu, et non à un effet antiexcitotoxique. Le bénéfice thérapeutique, comme les IAChE, a été démontré. Notamment par la méta-analyse Cochrane avec des études en double aveugle contre placebo. Ainsi, au stade modéré à sévère, les fonctions cognitives et le déclin fonctionnel chez le patient s'améliorent. Le médicament à reçu son AMM pour les patients atteints de la maladie d'Alzheimer ayant un MMS < 20.
Le choix du traitement :
Aujourd'hui, les inhibiteurs IAChE sont recommandés pour les stades léger à modéré de la
maladie d'Alzheimer (MMS compris entre 10 et 26 en moyenne) et les antiglutamates lorsque le patient arrive au stade sévère (MMS inférieur à 20). Comme dit précédemment, un inhibiteur de cholinestérase peut être couplé avec un antiglutamate car leurs effets et leur mode d'action étant différents, ils n'ont pas d'interaction et cela ne perturbe donc en rien leur efficacité.
Une étude en double aveugle contre placebo a dévoilé un modeste bénéfice lorsqu'un patient est sous bithérapie (soit sous inhibiteur IAChE et antiglutamate en même temps) notamment pendant la forme modérée de la maladie.
Les médicaments peuvent entrainer des effets secondaires indésirables principalement
digestifs, cardiovasculaires et neuropsychiatriques. Ces effets négatifs peuvent parfois nécessiter l'arrêt du traitement. Il existe également un risque de perturbations médicamenteuses, notamment avec les psychotropes qui sont souvent co-prescrits. Il est également nécessaire de réévaluer attentivement l'utilisation des médicaments à un an et au cas pas cas lorsque les données cliniques à long terme sont absentes. C'est après une réunion de concertation pluridisciplinaire que la pertinence de la continuation du traitement après un an est décidée.
Par ailleurs, la Galantamine peut être aussi associée à une maladie cérébro-vasculaire et la
Rivastagmine à la maladie de Parkinson.
Il faut tout de même considérer comme faible l'intérêt thérapeutique des médicaments contre
la maladie d'Alzheimer.
C – Les nouvelles perspectives
De nombreuses recherches sont aujourd'hui en cours afin de trouver des thérapeutiques qui
agiraient directement sur les causes de la maladie d'Alzheimer dans le but de ralentir son évolution ou même de la guérir. La plus grosse partie du traitement reste tout de même les médicaments qui sont forts indispensables dans la prise en charge de la maladie. Bien que leurs améliorations ne soient pas significatives, elles sont bénéfiques sur la vie quotidienne du patient (ainsi que pour son entourage). C'est pourquoi, d'importants efforts sont fournis dans la recherche de nouveaux médicaments. On espèrerait par exemple la mise en place future d'un vaccin ou bien de différents anti-oxydants et anti-inflammatoires supposés offrir une protection contre la maladie.
Mais la recherche pour la maladie d'Alzheimer découle des mêmes objectifs, visant directement les lésions causées par la maladie les plus importantes :
Perspectives ciblées sur les plaques amyloïdes :
On sait dorénavant que la voie amyloïde pathogène joue un rôle central de la maladie. Il
existe ainsi des arguments en faveur de ce rôle important concernant les peptides β-amyloïde : > L'analyse des formes monogéniques sont, dans la quasi totalité, associées à l'augmentation de la production de peptides β-amyloïde.
> Les personnes atteintes de trisomie 21 sont porteuses de trois copies du gène annonciateur de l'amyloïde. À l'âge adulte, elles développent la plupart du temps les démences de la maladie d'Alzheimer.
> La neurotoxicité du peptide amyloïde est confortée par des expérimentations animales (notamment sur la souris).
C'est pourquoi les chercheurs s'orientent plutôt vers cette voie amyloïde.
La destruction des plaques séniles (plaques Bêta-amyloïde), vu, aujourd'hui, par une
injection d'anticorps qui pourraient anéantir ces plaques. En effet, elles sont la principale cause des symptômes de la maladie, voire de la maladie en elle-même. L'anticorps développé actuellement qui reste en cours d'évaluation clinique et subit une série de test auprès de personnes atteintes de la maladie est le bapineuzumab. Cette solution utilisant les anticorps se nomme « vaccin thérapeutique ». Une autre approche en perspective consisterait à activer certaines cellules du cerveau (ici les microglies) afin qu'elles éliminent les plaques de protéines.
Moduler/Réduire la production du peptide β-amyloïde : Grâce au développement d'une
molécule qui agit sur la fonction de la γ secrétase soit l'augmentation de la réaction du peptide. Un inhibiteur de la γ secrétase a fait l'objet d'une première étude par les laboratoires LILLY. Il semble être supporté. Les inhibiteurs de la β-secrétase sont aussi en étude. La stimulation de la voie non pathogène pour augmenter l'activité de l' α-secrétase pourrait être une autre approche, afin d'empêcher la libération de peptide β-amyloïde.
Inhibition de l'agrégation du peptide β-amyloïde une fois produit :
Ce traitement a pour but d'empêcher la formation d'amas d'oligomères du peptide Aβ. Un
essai thérapeutique de phase II est en cours (La phase II consiste à déterminer la dose optimale du médicament et ses éventuels effets secondaires) avec l'Alzhemed, un glycoaminoglycane (un glucide de haut poids moléculaire qui forme avec des protéines, les protéoglycanes) qui pourrait fixer le peptide Aβ et ainsi empêcher la formation d'amas potentiellement toxiques.
Une diminution significative des dépôts d'Aβ dans un modèle de souris transgéniques (souris dont le génome a été modifié par introduction d'un gène) a été ainsi observée après 9 semaines de traitement avec le Clioquinol. Une étude de phase II / III (phase servant à comparer l'efficacité du traitement avec un traitement de référence) avec le Clioquinol vient d'être interrompue.
L'immunothérapie A-β : Le but de l'immunothérapie est de stimuler les mécanismes
immunitaires quand ceux-ci sont insuffisants, on parle d'immunostimulation. L'immunothérapie recouvre aujourd'hui une grande famille de solutions thérapeutiques préventives ou curatives faisant appel au système immunitaire des individus. L'immunothérapie a vraiment débuté au cours des années 1960, avec l'apparition des greffes de moelle osseuse, qui transfèrent des cellules immunitaires (lymphocytes) du donneur au receveur. Les thérapeutiques (partie de la médecine qui étudie et applique le traitement des maladies) disponibles se sont accrues, dans le dernier quart du XXe siècle, avec l'isolement de substances produites au cours d'une réaction immunitaire (cytokines) et avec la possibilité de modifier des lymphocytes en dehors de l'organisme.
L'immunothérapie a ouvert la voie aux thérapeutiques ayant un objectif préventif, curatif oui
qui ralentit le développement de la maladie d'Alzheimer. Au stade actuel, l'utilité et la tolérance
d'un vaccin anti-Aβ42 chez l'homme restent à démonter. Cette première déception permettra sans
doute de progresser encore dans la connaissance de l'immunothérapie anti Aβ 42.
Mais les recherches continuent.
Perspectives ciblées sur les dégénérescence neurofibrillaire ou les proteines tau :
La fonction biologique normale des protéines tau est perturbée par leur hyperphoshorylation.
Mais elle peut être rétablie par la déphosphorylation (soustraction d'un groupe phosphate à une molécule) grâce aux phosphatases. Il s'agirait d'empêcher l'hyperphosphorylation des protéines tau en réduisant les sites de phosphorylation où de nombreux kinases s'y trouvent abondamment. Particulièrement parmi eux, la glycogènes cynthase kinase 3 – β (GSK 3β), la cdc2-like kinase (cdk 5), la signalregulating kinase-2 (ERK 2), la microtubule-affinity-regulating kinase (MARK) et la protéine kinase A (PKA). Celles mises en avant sont la cdk 5 et la GSK 3β. Malgré cela, il n'y a toujours pas d'étude réalisée concernant ces molécules.
Le remplacement des neurones : Grâce à une transplantation de neurones, ceux détruits par
la maladie seraient remplacés. La communauté scientifique place beaucoup d'espoir dans cette solution mais aujourd'hui, les neurones créés à partir de cellules souches obtenus par prélèvement de peau humaine ne possèdent pas l'ensemble des caractéristiques et propriétés des neurones « naturels ». La technique n'est donc pas tout à fait au point mais pourrait faire l'œuvre d'un traitement dans quelques années, surtout qu'elle ne ferait pas seulement l'objet de la maladie d'Alzheimer.
Récemment, une étude sur des souris a été faite et pourrait être très prometteuse. Le
traitement pourrait même se révéler révolutionnaire pour la maladie d'Alzheimer. Il s'agit d'un médicament déjà commercialisé pour le cancer dont la molécule est le bexarotène.
Molécule de bexarotène
Alzheimer : le Bexarotène, nouvel espoir pour les malades ?
Un médicament contre le cancer — le Bexarotène — a rapidement restauré les fonctions
cérébrales normales de souris de laboratoire atteintes de l'équivalent d'Alzheimer, selon une étude
publiée dans la revue américaine « Science » du 10 février. Une avancée pouvant déboucher sur un
traitement pour cette maladie incurable et dévastatrice, estiment les chercheurs de Cleveland (Etats-
Unis).
Non seulement cet anti-cancéreux, le bexarotene, a fait disparaître chez ces souris jusqu'à 75% des plaques de bêta-amyloïde, une forme de protéine dont l'accumulation est une des principales caractéristiques pathologiques d'Alzheimer mais il a aussi inversé les symptômes de cette maladie, comme
Le bexarotene, initialement développé par le laboratoire américain Ligand Pharmaceuticals sous le nom de marque Targretin, avait été approuvé par l'Agence américaine des médicaments (FDA) en 1999. Il traite un cancer rare dit lymphome cutané à cellule T.
Le laboratoire japonais Eisai a racheté les droits mondiaux du bexarotene en 2006.
Tout juste 72 heures après avoir commencé le traitement avec le bexarotene, les souris de laboratoire --génétiquement modifiées pour développer l'équivalent de la maladie d'Alzheimer-- ont commencé à montrer des comportements normaux, expliquent les chercheurs à l'origine de cette étude.
Ces animaux ont ainsi retrouvé leur mémoire et le sens de l'odorat, explique à l'AFP le Dr Daniel Wesson, professeur adjoint de neurosciences à la faculté de médecine Case Western à Cleveland (Ohio, Nord), principal co-auteur de l'étude publiée dans la revue américaine Science datée du 10 février.
Il note que la perte de l'odorat est souvent le premier signe de la maladie d'Alzheimer chez les humains. Le Parisien
Source de l'article : Le Parisien, 10.02.2012
Pour un article plus détaillé :
Le bexarotène a donc montré des capacités de destruction des plaques amyloïdes et une
inversion de certains symptômes de la maladie d'Alzheimer. Mais cela chez des souris de laboratoire. Il est donc nécessaire de reproduire ces résultats dans d'autres laboratoires avant de pouvoir l'utiliser sur l'humain.
Le bexarotène est un anticancéreux, il correspond donc parfaitement au traitement contre les
lymphomes et cancers similaires. La maladie d'Alzheimer a un mécanisme bien différent, ce n'est pas un syndrome néoplasique. Les effets sur le tissu cérébral restent donc incertains. De plus, la maladie d'Alzheimer implique deux principales lésions (plaques amyloïdes et dégénérescences neurofibrillaires ou protéine tau) et le bexarotène ne résoudrait qu'une seule de ces deux lésions.
Les résultats étant récents, il faut attendre des études multi-orientées (biochimiques,
biologiques, immunologiques …) pour envisager d'utiliser la molécule de bexarotène dans un autre cadre que les cancers.
Notre production tente de répondre à une question précise, «Pourquoi la maladie d'Alzheimer est-elle aussi grave ?». Ainsi, tout au long du TPE, nous avons organisé une réponse qui apparaît maintenant clairement.
Tout d'abord, le premier point noir causé par cette maladie à mettre en évidence est celui des chiffres alarmants la concernant : il y a de plus en plus de personnes atteintes, en France comme dans le monde. Pour ne rien arranger, le dépistage de la maladie est très difficile, peu de techniques permettent de dire avec certitude si un individu est atteint avant qu'il ne soit déjà à un stade sévère de la maladie. Les premiers symptômes sont très difficiles à identifier comme étant ceux de la maladie. De ce fait, de nombreuses personnes vivent avec Alzheimer sans le savoir, ou en le niant. Aussi, cette maladie est grave dans le sens où elle s'aggrave avec le temps, devenant de plus en plus forte et terrible face au malade, pouvant provoquer sa mort. Le plus grave est qu'à ce jour, on ne sait que très peu de choses à son sujet, médecins comme chercheurs. En effet, on se sait pas comment guérir d'Alzheimer, on ne peut et ne sait soigner cette maladie incurable. Il existe seulement quelques traitements capables de freiner son aggravation et de permettre au malade de se sentir un peu mieux.
Nous ne pouvons qu'espérer pouvoir un jour guérir de la maladie d'Alzheimer, qui reste à l'heure actuelle, pour toute ses raisons, une maladie extrêmement grave.
Remerciement :
Nous remercions particulièrement notre professeur d'SVT, Mme CASCONE ainsi que notre professeur de Physique-Chimie, Mme VANDESOMPELE pour nous avoir encouragé tout au long de notre TPE et pour avoir subit en premier notre test farfelu. Nous remercions également Jean PERRET pour nous avoir accordé un entretien plutôt particulier. Il en va de même pour Mireille BONNET, Marc BONNET ainsi que Christine LACOMBE pour l'attention et le temps qu'ils nous ont consacrés.
Malheureusement, nous n'avons pas eu l'occasion de rencontrer une personne atteinte de maladie d'Alzheimer et cela reste notre principale déception en fin de ce TPE.
Bibliographie :
Cours de Neuropsychologie, Master II, Professeur Christian DEROUESNE (Université Paris VI, CHU Pitié-Salpêtrière)Science&Vie n°1032, septembre 2003, Spécial Mémoire.
« Dictionnaire médical de l'infirmière », édition Masson.
« Pour la science » Spécial cerveau, Numéro 302
Entretien avec un couple: Mireille BONNET, psychiatre, Marc BONNET, psychanalyste.
Entretien avec Christine LACOMBE, étudiante en master II de neuropsychologie.
Entretien avec Jean PERRET, neurologue, président de la Fédération Française de Neurologie.
Lexique :
Acétylcholine : Agent de transmission des messages nerveux présent dans le cerveau
Acide glutamique : Acide aminé contenu dans les tissus nerveux
Atrophie corticale : Réduction visible du cerveau
Cortex : couche externe d'un organe ou d'une structure, par opposition à sa couche interne
Dégénérescence : Altération d'un tissu ou d'un organe dont les cellules perdent leurs caractéristiques spécifiques et se transforment en une substance inerte.
Démence : La démence est une diminution de toutes les facultés intellectuelles d'un individu, à la suite d'une pathologie cérébrale organique.
Dephosphorylation : Soustraction d'un groupe phosphate (PO4) à une protéine ou à une petite molécule, faite par les phosphatases.
Étude épidemiologique : Étude de la fréquence des maladies dans divers groupes de la population
Excipient : Substance neutre que l'on incorpore à un médicament pour son absorption
Faculté cognitive : Capacité de réfléchir, de se concentrer, d'exposer des idées, de raisonner ainsi que sur la mémoire
Glutamate : sel de l'acide glutamique
hyperphoshorylation : Saturation dans le fonctionnement hormonal suite à un développement excessif de l'apport en phosphore.
Hyppocampe : Zone du cerveau essentielle à la mémoire et l'apprentissage, située pour moitié dans l'hémisphère droit, et pour moitié dans le gauche.
Lésion : Blessure d'une partie de l'organisme
Mnesique : Qui se rapporte à la mémoire
Neurodégénérative (maladie) : qui affecte le fonctionnement du cerveau ou plus généralement le système nerveux de façon progressive au cours de son évolution.
phosphorylation : Addition d'un groupe phosphate (PO4) à une protéine ou à une petite molécule, telle le glucose ou l'adénine, faite par diverses protéines kinases spécifiques.
Praxie : Coordination normale des mouvements volontaires
Principe actif : Molécule entrant dans la composition d'un médicament et lui conférant ses propriétés thérapeutiques
Protéine : Grosse molécule composée d'acides aminés présent dans tous les tissus de l'organisme
Stigmine : Les stigmines sont des inhibiteurs de cholinestérase plus ou moins sélectifs selon la molécule considérée
Symptôme : Phénomène lié à l'existence d'une maladie
Annexes :
Affiche de campagne pour l'aide au personne atteinte de la maladie d'Alzheimer
Source: http://data0.eklablog.net/tpe1ere-alzheimer/perso/tpe-alzheimer.pdf
MINISTERIO DE LA PRESIDENCIA DIRECCION ADMINISTRATIVA INFORME DE INGRESOS Y GASTOS FONDO PROGRAMA DEL DESPACHO SUPERIOR Del 1 de Julio de 2007 al 30 de Septiembre de 2007 Transferencias recibidas del Tesoro Nacional y otros Reembolso H.D. Jorge Alvarado 7894612 Depósito MEF No.7122110 Nota de crédito por reembolso de gastos médicos San Vicente de Paul de Colombia del el joven Gilberto Araúz por
Naturetrek Tour Report 22 - 29 April 2016 Hermann's Tortoise Report and images by Ian Nicholson & Martin Beaton T: +44 (0)1962 733051 Tour Report Tour participants: Ian Nicholson & Martin Beaton (leader) with 14 Naturetrek clients This holiday looked at all aspects of wildlife on the attractive island of Menorca, focussing mainly on birds and plants, but also including butterflies and dragonflies, although it was slightly early in the season for the latter two groups. The weather was somewhat mixed, with a couple of chilly mornings, but also some sunny afternoons, and during the course of the week we saw a good variety of wildlife, as well as touching briefly on some of the history of the island.







